| Mọi thông tin dưới đây đã được Dược sĩ biên soạn lại. Tuy nhiên, nội dung hoàn toàn giữ nguyên dựa trên tờ Hướng dẫn sử dụng, chỉ thay đổi về mặt hình thức. |
1. Thành phần
Mỗi lọ 20 mL chứa:
- Thành phần dược chất: Daratumumab 400 mg (20 mg daratumumab mỗi mL).
- Thành phần tá dược: Acid acetic băng, Mannitol (E421), Polysorbate 20, Natri acetate trihydrate, Natri chloride, Nước để tiêm.
2. Công dụng (Chỉ định)
DARZALEX được chỉ định:
- Kết hợp với lenalidomide và dexamethasone hoặc với bortezomib, melphalan và prednisone để điều trị cho bệnh nhân người lớn mới chẩn đoán đa u tủy mà không đạt tiêu chuẩn cho ghép tế bào gốc tự thân.
- Kết hợp với bortezomib, thalidomide và dexamethasone để điều trị cho bệnh nhân người lớn mới chẩn đoán đa u tủy mà đạt tiêu chuẩn cho ghép tế bào gốc tự thân.
- Kết hợp với lenalidomide và dexamethasone, hoặc bortezomib và dexamethasone để điều trị cho bệnh nhân người lớn bị đa u tuỷ mà đã nhận được ít nhất một trị liệu trước đó.
- Như một đơn trị liệu để điều trị cho bệnh nhân người lớn bị đa u tủy tái phát và kháng trị, mà liệu pháp điều trị trước đó đã bao gồm một chất ức chế proteasome và một thuốc điều hòa miễn dịch và những bệnh nhân này đã cho thấy bệnh tiến triển với liệu pháp điều trị sau cùng.
3. Cách dùng – Liều dùng
Cách dùng
DARZALEX được dùng theo đường tĩnh mạch. Thuốc được truyền tĩnh mạch sau khi pha loãng với dung dịch pha tiêm natri chloride 9 mg/mL (0,9%). Đối với hướng dẫn pha loãng sản phẩm trước khi dùng thuốc.
Liều dùng
DARZALEX cần được truyền bởi một nhân viên y tế, trong một môi trường có sẵn các phương tiện hồi sức.
Nên dùng các thuốc trước và sau khi truyền để giảm nguy cơ các phản ứng liên quan đến truyền thuốc của daratumumab (infusion‑related reactions – IRRs). Xem dưới đây “Các thuốc khuyến cáo dùng kết hợp”, “Quản lý các phản ứng liên quan đến truyền thuốc”.
Liệu trình dùng kết hợp với lenalidomide (phác đồ chu kỳ 4 tuần) và liệu trình đơn trị liệu
Liều khuyến cáo của DARZALEX là 16 mg/kg thể trọng được truyền tĩnh mạch theo liệu trình trong Bảng 1.
Bảng 1: Liệu trình DARZALEX kết hợp với lenalidomide (phác đồ liều chu kỳ 4 tuần) và liệu trình đơn trị liệu.
Tuần | Liệu trình |
Tuần 1 đến 8 | Hàng tuần (tổng cộng 8 liều) |
Tuần 9 đến 24a | Mỗi hai tuần (tổng cộng 8 liều) |
Tuần 25 trở đi cho đến khi bệnh tiến triểnb | Mỗi bốn tuần |
a Liều đầu tiên của liệu trình mỗi 2 tuần được dùng vào Tuần 9.
b Liều đầu tiên của liệu trình mỗi 4 tuần được dùng vào Tuần 25.
Liều dùng và liệu trình của các thuốc chỉ định kết hợp cùng DARZALEX, xem phần Tóm tắt đặc tính sản phẩm tương ứng.
Liệu trình dùng kết hợp với bortezomib, melphalan và prednisone (phác đồ chu kỳ 6 tuần)
Liều khuyến cáo của DARZALEX là 16 mg/kg thể trọng được truyền tĩnh mạch theo liệu trình trong Bảng 2.
Bảng 2: Liệu trình DARZALEX kết hợp với bortezomib, melphalan và prednisone ([VMP]; phác đồ liều chu kỳ 6 tuần).
Tuần | Liệu trình |
Tuần 1 đến 6 | Hàng tuần (tổng cộng 6 liều) |
Tuần 7 đến 54a | Mỗi ba tuần (tổng cộng 16 liều) |
Tuần 55 trở đi cho đến khi bệnh tiến triểnb | Mỗi bốn tuần |
a Liều đầu tiên của liệu trình mỗi 3 tuần được dùng vào Tuần 7.
b Liều đầu tiên của liệu trình mỗi 4 tuần được dùng vào Tuần 55.
Bortezomib được dùng hai lần mỗi tuần vào Tuần 1, 2, 4 và 5 cho chu kỳ 6 tuần đầu tiên, tiếp nối bởi một lần mỗi tuần vào Tuần 1, 2, 4 và 5 cho tám chu kỳ 6 tuần nữa. Thông tin về liều và liệu trình của VMP khi dùng kết hợp với DARZALEX.
Liệu trình phối hợp với bortezomib, thalidomide và dexamethasone (các phác đồ chu kỳ 4 tuần) để điều trị cho bệnh nhân mới chẩn đoán mà đạt tiêu chuẩn cho ghép tế bào gốc tự thân (ASCT).
Liều khuyến cáo của DARZALEX là 16 mg/kg thể trọng truyền tĩnh mạch theo liệu trình trong Bảng 3.
Bảng 3: Liệu trình DARZALEX dùng phối hợp với bortezomib, thalidomide và dexamethasone ([VTd]; phác đồ chu kỳ 4 tuần).
Chu kỳ điều trị | Tuần | Liệu trình |
Tấn công | Tuần 1 đến 8 | Hàng tuần (tổng cộng 8 liều) |
Tuần 9 đến 16a | Mỗi hai tuần (tổng cộng 4 liều) | |
Ngừng để dùng hóa trị liều cao và ASCT | ||
Củng cố | Tuần 1 đến 8b | Mỗi hai tuần (tổng cộng 4 liều) |
a Liều đầu tiên của liệu trình mỗi 2 tuần được dùng vào Tuần 9.
b Liều đầu tiên của liệu trình mỗi 2 tuần được dùng vào Tuần 1 khi bắt đầu điều trị lại sau ASCT.
Về liều và liệu trình của các thuốc dùng phối hợp với DARZALEX, xem phần Tóm tắt đặc tính sản phẩm tương ứng.
Liệu trình phối hợp với bortezomib (phác đồ liều chu kỳ 3 tuần):
Liều khuyến cáo của DARZALEX là 16 mg/kg thể trọng truyền tĩnh mạch theo liệu trình trong Bảng 4.
Bảng 4: Liệu trình DARZALEX dùng phối hợp với bortezomib (phác đồ liều chu kỳ 3 tuần).
Tuần | Liệu trình |
Tuần 1 đến 9 | Hàng tuần (tổng cộng 9 liều) |
Tuần 10 đến 24a | Mỗi ba tuần (tổng cộng 5 liều) |
Tuần 25 trở đi cho đến khi bệnh tiến triểnb | Mỗi bốn tuần |
a Liều đầu tiên của liệu trình mỗi 3 tuần được dùng vào Tuần 10.
b Liều đầu tiên của liệu trình mỗi 4 tuần được dùng vào Tuần 25.
Thông tin về liều dùng và liệu trình của các thuốc dùng phối hợp với DARZALEX, xem phần 5.1 và Tóm tắt đặc tính sản phẩm tương ứng.
Tốc độ truyền
- Sau khi pha loãng, cần truyền DARZALEX theo đường tĩnh mạch với tốc độ truyền ban đầu được trình bày trong Bảng 5 dưới đây. Chỉ cân nhắc gia tăng tốc độ truyền khi không có các phản ứng liên quan đến truyền thuốc.
- Để sử dụng thuận tiện, liều kê toa đầu tiên 16 mg/kg tại Tuần 1 có thể được chia cho hai ngày liên tiếp ví dụ mỗi ngày 8 mg/kg vào Ngày 1 và Ngày 2 tương ứng, xem Bảng 5 dưới đây.
Bảng 5: Tốc độ truyền DARZALEX (16 mg/kg).
| Thể tích pha loãng | Tốc độ ban đầu (giờ đầu tiên) | Bậc tănga | Tốc độ tối đa |
Truyền Tuần 1 | ||||
Lựa chọn 1 (Truyền liều duy nhất) |
| |||
Tuần 1 Ngày 1 (16 mg/kg) | 1.000 mL | 50 mL/giờ | 50 mL/giờ mỗi giờ | 200 mL/giờ |
Lựa chọn 2 (Chia liều) |
| |||
Tuần 1 Ngày 1 (8 mg/kg) | 500 mL | 50 mL/giờ | 50 mL/giờ mỗi giờ | 200 mL/giờ |
Tuần 1 Ngày 2 (8 mg/kg) | 500 mL | 50 mL/giờ | 50 mL/giờ mỗi giờ | 200 mL/giờ |
Truyền Tuần 2 (16 mg/kg)b | 500 mL | 50 mL/giờ | 50 mL/giờ mỗi giờ | 200 mL/giờ |
Truyền các lần sau đó (Tuần 3 trở đi, 16 mg/kg)c | 500 mL | 100 mL/giờ | 50 mL/giờ mỗi giờ | 200 mL/giờ |
a Chỉ cân nhắc tăng tốc độ truyền khi không có các phản ứng do truyền.
b Chỉ sử dụng thể tích pha loãng 500 mL cho liều 16 mg/kg nếu không có IRR trong tuần trước. Nếu không, sử dụng thể tích pha loãng 1.000 mL.
c Chỉ thay đổi tốc độ truyền ban đầu (100 mL/giờ) cho các lần truyền tiếp theo (ví dụ từ Tuần 3 trở đi) nếu không có IRR trong lần truyền trước. Nếu không, tiếp tục sử dụng theo hướng dẫn về tốc độ truyền cho Tuần 2 nêu trong bảng này.
Quản lý các phản ứng liên quan đến truyền thuốc
Trước khi điều trị bằng DARZALEX, cần dùng các thuốc dùng trước khi truyền để giảm nguy cơ các phản ứng liên quan đến truyền thuốc (IRRs).
Đối với IRRs ở bất kỳ độ/mức độ nghiêm trọng nào, ngừng truyền DARZALEX ngay lập tức và điều trị các triệu chứng.
Việc quản lý các IRR có thể cần phải giảm tốc độ truyền thêm nữa, hoặc ngừng sử dụng DARZALEX như được tóm tắt dưới đây.
- Độ 1-2 (nhẹ đến trung bình): Một khi các triệu chứng của phản ứng được giải quyết, cần tiếp tục truyền với tốc độ không quá một nửa tốc độ truyền mà tại đó xuất hiện IRR. Nếu bệnh nhân không gặp thêm bất kỳ triệu chứng IRR nào khác, có thể tăng tốc độ truyền theo từng bậc với khoảng cách tùy theo lâm sàng cho đến tốc độ tối đa là 200 mL/giờ (Bảng 5).
- Độ 3 (nặng): Một khi các triệu chứng của phản ứng được giải quyết, có thể cân nhắc truyền lại với tốc độ không quá một nửa tốc độ truyền mà tại đó xảy ra phản ứng. Nếu bệnh nhân không bị thêm các triệu chứng nào khác, có thể tăng tốc độ truyền theo bậc với khoảng cách thích hợp (Bảng 5). Cần lặp lại quy trình trên trong trường hợp tái phát các triệu chứng Độ 3. Ngừng vĩnh viễn DARZALEX khi xảy ra lần thứ ba phản ứng liên quan đến truyền từ Độ 3 trở lên.
- Độ 4 (đe dọa đến tính mạng): Ngừng vĩnh viễn điều trị bằng DARZALEX.
Điều chỉnh liều
Không khuyến cáo giảm liều DARZALEX. Có thể cần trì hoãn liều để cho phép phục hồi số lượng tế bào máu trong biến cố có độc tính huyết học. Để biết thông tin liên quan đến các thuốc được phối hợp với DARZALEX, xem Tóm tắt đặc tính sản phẩm tương ứng.
Các loại thuốc dùng đồng thời được khuyến cáo
Thuốc dùng trước khi truyền
Để giảm nguy cơ IRR cho tất cả các bệnh nhân cần dùng các thuốc dùng trước khi truyền vào thời điểm 1-3 giờ trước mỗi lần truyền DARZALEX như sau:
Corticosteroid (tác dụng kéo dài hoặc tác dụng trung bình)
- Đơn trị liệu: Methylprednisolone 100 mg, hoặc tương đương, dùng đường tĩnh mạch. Sau lần truyền thứ hai, liều corticosteroid có thể giảm xuống (methylprednisolone 60 mg dùng đường uống hoặc tĩnh mạch).
- Điều trị kết hợp: Dexamethasone 20 mg (hoặc tương đương), dùng trước mỗi lần truyền DARZALEX. Khi dexamethasone là corticosteroid đặc hiệu trong phác đồ nền, thì liều điều trị dexamethasone này sẽ dùng thay thế cho thuốc dùng trước khi truyền vào những ngày truyền DARZALEX. Dexamethasone dùng theo đường tĩnh mạch trước khi truyền DARZALEX lần đầu tiên và có thể xem xét dùng đường uống trước các lần truyền tiếp theo. Không dùng thêm corticosteroid đặc hiệu của phác đồ điều trị nền (như prednisone) vào ngày truyền DARZALEX khi bệnh nhân đã dùng dexamethasone như là thuốc dùng trước truyền.
Thuốc hạ sốt (paracetamol uống 650 đến 1.000 mg).
Thuốc kháng histamin (diphenhydramine dùng đường uống hoặc tĩnh mạch 25 đến 50 mg hoặc tương đương).
Các thuốc dùng sau khi truyền thuốc
Cần dùng thuốc sau khi truyền để giảm nguy cơ các phản ứng liên quan đến truyền thuốc xuất hiện muộn, cụ thể:
- Đơn trị liệu: Nên dùng corticosteroid uống (20 mg methylprednisolone hoặc liều tương đương của một corticosteroid tác dụng kéo dài hoặc tác dụng trung bình theo tiêu chuẩn của địa phương) vào mỗi ngày trong hai ngày sau tất cả các lần truyền (bắt đầu vào ngày sau khi truyền).
- Điều trị kết hợp: Cân nhắc dùng methylprednisolone uống liều thấp (≤ 20 mg) hoặc tương đương vào ngày sau khi truyền DARZALEX. Tuy nhiên, nếu đã dùng corticosteroid đặc hiệu theo phác đồ nền (ví dụ như phác đồ có dexamethasone, prednisone) vào ngày sau khi truyền DARZALEX, có thể không cần dùng thêm corticosteroid sau khi truyền.
- Ngoài ra, đối với bệnh nhân có tiền sử bệnh phổi tắc nghẽn mạn tính, cần phải xem xét sử dụng các thuốc sau truyền bao gồm thuốc giãn phế quản tác dụng ngắn và kéo dài, và corticosteroid dạng hít. Sau bốn lần truyền đầu tiên, nếu bệnh nhân không bị các IRR đáng kể, có thể ngừng các thuốc dạng hít dùng sau truyền theo quyết định của bác sĩ.
Dự phòng tái hoạt hóa virus herpes zoster
Cần xem xét dự phòng bằng thuốc kháng virus để ngăn ngừa sự tái hoạt hóa virus herpes zoster.
Các nhóm dân số đặc biệt
Suy thận
Chưa thực hiện các nghiên cứu chính thức về daratumumab trên bệnh nhân suy thận. Dựa trên phân tích dược động học (PK) quần thể, không cần điều chỉnh liều cho bệnh nhân suy thận.
Suy gan
- Chưa thực hiện các nghiên cứu chính thức về daratumumab trên bệnh nhân suy gan.
- Dựa trên phân tích dược động học (PK) quần thể, không cần điều chỉnh liều cho bệnh nhân suy gan.
Người cao tuổi
Không cần điều chỉnh liều.
Nhóm dân số trẻ em
- Tính an toàn và hiệu quả của DARZALEX ở trẻ em dưới 18 tuổi chưa được thiết lập.
- Hiện chưa có dữ liệu.
– Quá liều
Các triệu chứng và dấu hiệu
Không có kinh nghiệm về quá liều trong các nghiên cứu lâm sàng. Đã dùng liều lên đến 24 mg/kg theo đường tĩnh mạch trong một nghiên cứu lâm sàng.
Điều trị
Chưa có thuốc giải độc đặc hiệu để điều trị quá liều daratumumab. Trong trường hợp dùng thuốc quá liều, cần theo dõi bệnh nhân về bất kỳ dấu hiệu hoặc triệu chứng nào của các tác dụng bất lợi và phải tiến hành điều trị triệu chứng phù hợp ngay.
– Quên liều
Nếu liều dự kiến của DARZALEX bị bỏ quên, cần dùng lại liều càng sớm càng tốt và cần phải điều chỉnh liệu trình dùng thuốc tương ứng, duy trì khoảng cách điều trị.
4. Chống chỉ định
Quá mẫn với hoạt chất hoặc với bất kỳ tá dược nào được liệt kê.
5. Tác dụng phụ
Tóm tắt thông tin an toàn
Các phản ứng có hại thường gặp nhất của bất kỳ mức độ nào ≥ 20% là các phản ứng do truyền thuốc, mệt mỏi, buồn nôn, tiêu chảy, táo bón, sốt, khó thở, ho, giảm bạch cầu trung tính, giảm tiểu cầu, thiếu máu, phù ngoại biên, suy nhược, bệnh lý thần kinh cảm giác ngoại biên và nhiễm trùng đường hô hấp trên. Phản ứng có hại nghiêm trọng là nhiễm trùng huyết, viêm phổi, viêm phế quản, nhiễm trùng đường hô hấp trên, phù phổi, cúm, sốt, mất nước, tiêu chảy và rung nhĩ.
Phản ứng có hại được trình bày dưới dạng bảng
- Bảng 6 tóm tắt các phản ứng có hại xuất hiện ở bệnh nhân dùng DARZALEX. Dữ liệu phản ánh tình hình sử dụng DARZALEX (16 mg/kg) của 2066 bệnh nhân đa u tủy bao gồm 1910 bệnh nhân điều trị bằng DARZALEX kết hợp với các phác đồ cơ bản và 156 bệnh nhân dùng DARZALEX đơn trị liệu. Bảng này cũng bao gồm các phản ứng có hại ghi nhận sau khi thuốc lưu hành.
- Trong nghiên cứu MMY3006, số lượng tế bào CD34+ thấp hơn ở nhóm D-VTd so với nhóm VTd (Trung vị: D-VTd: 6,3 x 106/kg; VTd 8,9 x 106/kg), và trong số những người đã hoàn thành việc huy động tế bào gốc, số bệnh nhân trong nhóm D-VTd được nhận plerixafor cao hơn so với nhóm VTd (D-VTd: 21,7%; VTd: 7,9%). Tỷ lệ tái tạo mô và hồi phục tế bào máu là tương tự nhau trong số các đối tượng được cấy ghép trong nhóm D-VTd và nhóm VTd (D-VTd: 99,8%; VTd: 99,6%; được xác định bằng sự phục hồi của bạch cầu trung tính > 0,5 x 109/L, bạch cầu > 1,0 x 109/L và tiểu cầu > 50 x 109/L mà không cần truyền máu).
- Tần suất được định nghĩa là: rất thường gặp (≥1/10), thường gặp (≥1/100 đến <1/10), ít gặp (≥1/1.000 đến <1/100), hiếm gặp (≥1/10.000 đến <1/1.000) và rất hiếm gặp (<1/10.000). Trong mỗi nhóm tần suất, khi phù hợp, phản ứng có hại được trình bày theo thứ tự giảm dần về mức độ nghiêm trọng.
Bảng 6: Các phản ứng có hại ở bệnh nhân đa u tủy điều trị bằng DARZALEX 16 mg/kg.
Hệ cơ quan | Phản ứng bất lợi | Tần suất | Tỷ lệ (%) | |
Bất kỳ độ nào | Độ 3‑4 | |||
Nhiễm trùng và nhiễm ký sinh trùng | Viêm phổi a | Rất thường gặp | 16 | 10 |
Viêm phế quản a | 17 | 2 | ||
Nhiễm trùng đường hô hấp trên a | 41 | 3 | ||
Nhiễm trùng đường tiết niệu | Thường gặp
| 8 | 1 | |
Cúm | 5 | 1* | ||
Nhiễm trùng huyết a | 4 | 4 | ||
Nhiễm virus Cytomegalo a | 1 | <1* | ||
Tái hoạt hóa virus viêm gan B b | Ít gặp | – | – | |
Rối loạn hệ máu và bạch huyết | Giảm bạch cầu trung tính a | Rất thường gặp | 44 | 39 |
Giảm tiểu cầu a | 31 | 19 | ||
Thiếu máu a | 27 | 12 | ||
Giảm bạch cầu lympho a | 14 | 11 | ||
Giảm bạch cầu a | 12 | 6 | ||
Rối loạn hệ miễn dịch | Phản ứng phản vệ b | Hiếm gặp | – | – |
Rối loạn chuyển hoá và dinh dưỡng | Giảm ngon miệng | Rất thường gặp | 12 | 1 |
Tăng đường huyết | Thường gặp | 7 | 3 | |
Giảm calci máu | 6 | 1 | ||
Mất nước | 3 | 1* | ||
Rối loạn hệ thần kinh | Bệnh lý thần kinh cảm giác ngoại biên | Rất thường gặp
| 32
| 3 |
Dị cảm | 11 | <1 | ||
Đau đầu | 12 | <1* | ||
Rối loạn tim | Rung nhĩ | Thường gặp | 4 | 1 |
Rối loạn mạch | Tăng huyết áp a | Rất thường gặp | 10 | 5 |
Rối loạn hô hấp, lồng ngực và trung thất | Hoa | Rất thường gặp | 25 | <1* |
Khó thởa | 21 | 3 | ||
Phù phổi a | Thường gặp | 1 | <1 | |
Rối loạn hệ tiêu hóa | Tiêu chảy | Rất thường gặp | 32 | 4 |
Táo bón | 33 | 1 | ||
Buồn nôn | 26 | 2* | ||
Nôn | 16 | 1* | ||
Viêm tụy a | Thường gặp | 1 | 1 | |
Rối loạn cơ xương và mô liên kết | Đau lưng | Rất thường gặp | 18 | 2 |
Co thắt cơ | 14 | <1* | ||
Rối loạn toàn thân và tình trạng tại vị trí truyền thuốc | Mệt mỏi | Rất thường gặp | 26 | 4 |
Phù ngoại biên a | 26 | 1 | ||
Sốt | 23 | 2 | ||
Suy nhược | 21 | 2 | ||
Ớn lạnh | Thường gặp | 9 | < 1* | |
Chấn thương, ngộ độc và các biến chứng của thủ thuật | Phản ứng liên quan đến truyền thuốc c | Rất thường gặp | 40 | 4 |
* Không có Độ 4.
a Chỉ một nhóm các thuật ngữ.
b Phản ứng có hại ghi nhận sau khi thuốc lưu hành.
c Phản ứng liên quan đến truyền thuốc bao gồm các thuật ngữ được các nghiên cứu viên xác định là có liên quan đến truyền thuốc, xem dưới đây.
Mô tả các phản ứng bất lợi chọn lọc
Phản ứng liên quan đến truyền thuốc (IRRs)
- Trong các nghiên cứu lâm sàng (đơn trị liệu và điều trị phối hợp, N = 2066), tỷ lệ các phản ứng do truyền thuốc ở tất cả các độ là 37% với lần truyền DARZALEX đầu tiên (16 mg/kg, Tuần 1), 2% với lần truyền Tuần 2, và tích luỹ 6% với các lần truyền tiếp theo. Ít hơn 1% bệnh nhân có phản ứng liên quan đến truyền thuốc ở Độ 3/4 với lần truyền Tuần 2 hoặc tiếp theo.
- Trung vị thời gian đến khi xuất hiện một phản ứng là 1,5 giờ (khoảng: 0 đến 72,8 giờ). Tần suất điều chỉnh truyền do phản ứng là 36%. Trung vị khoảng thời gian truyền thuốc liều 16 mg/kg cho Tuần 1, Tuần 2 và tiếp sau đó tương ứng là khoảng 7, 4 và 3 giờ.
- Các phản ứng liên quan đến truyền thuốc mức độ nặng bao gồm co thắt phế quản, khó thở, phù thanh quản, phù phổi, thiếu oxy máu và tăng huyết áp. Các phản ứng có hại khác liên quan đến truyền là sung huyết mũi, ho, ớn lạnh, kích ứng họng, nôn và buồn nôn.
- Khi liều DARZALEX bị gián đoạn do việc ghép tế bào gốc tự thân (ASCT) (Nghiên cứu MMY3006) trong trung vị thời gian là 3,75 tháng (khoảng: 2,4; 6,9), sau khi bắt đầu điều trị lại DARZALEX tỷ lệ IRRs là 11% tại lần truyền đầu tiên sau khi ghép tế bào gốc tự thân. Tốc độ truyền/thể tích pha loãng được sử dụng khi điều trị lại giống như lần truyền DARZALEX cuối cùng trước khi bị gián đoạn do ASCT. IRRs, xảy ra sau khi điều trị lại DARZALEX sau khi ghép tế bào gốc tự thân là nhất quán về triệu chứng và mức độ nghiêm trọng (Độ 3/4: <1%) với những trường hợp được báo cáo trong các nghiên cứu trước đây tại Tuần 2 hay các lần truyền tiếp theo.
- Trong Nghiên cứu MMY1001, bệnh nhân điều trị daratumumab phối hợp (n = 97) được sử dụng vào Tuần 1 với daratumumab liều đầu tiên 16 mg/kg được chia thành hai ngày mỗi ngày 8 mg/kg vào Ngày 1 và Ngày 2. Tần suất phản ứng do truyền thuốc ở mức độ bất kỳ là 42%, với 36% bệnh nhân bị phản ứng do truyền thuốc vào Ngày 1 của Tuần 1, 4% vào Ngày 2 của Tuần 1, và 8% vào các lần truyền tiếp theo. Trung vị thời gian đến khi xuất hiện một phản ứng là 1,8 giờ (khoảng: 0,1 đến 5,4 giờ). Tần suất ngừng truyền do phản ứng là 30%. Trung vị thời gian truyền thuốc là 4,2 giờ cho Tuần 1-Ngày 1; 4,2 giờ cho Tuần 1-Ngày 2; và 3,4 giờ cho các lần truyền tiếp theo.
Nhiễm trùng
- Ở các bệnh nhân điều trị DARZALEX phối hợp, nhiễm trùng Độ 3 hoặc 4 được báo cáo như sau: Các nghiên cứu bệnh nhân tái phát/kháng trị: DVd: 21%, Vd: 19%; DRd: 27%, Rd: 23%; DPd: 28%.
- Các nghiên cứu bệnh nhân mới chẩn đoán: D-VMP: 23%; VMP: 15%; DRd: 32%, Rd: 23%; D-VTd: 22%, VTd: 20%.
- Viêm phổi là nhiễm trùng nghiêm trọng (Độ 3 hoặc 4) thường được báo cáo nhất trong tất cả các nghiên cứu. Trong các nghiên cứu có đối chứng với thuốc có hoạt tính, ngừng điều trị do nhiễm trùng đã xảy ra ở 1- 4% bệnh nhân. Nhiễm trùng gây tử vong chủ yếu là do viêm phổi và nhiễm trùng huyết (sepsis).
- Ở các bệnh nhân điều trị DARZALEX phối hợp, nhiễm trùng gây tử vong (Độ 5) được báo cáo như sau: Các nghiên cứu bệnh nhân tái phát/kháng trị: DVd: 1%, Vd: 2%; DRd: 2%, Rd: 1%; DPd: 2%. Các nghiên cứu bệnh nhân mới chẩn đoán: D-VMP: 1%, VMP: 1%; DRd: 2%, Rd: 2%; DVTd: 0%, VTd: 0%.
Lưu ý: D=daratumumab; Vd=bortezomib-dexamethasone; Rd=lenalidomide-dexamethasone; Pd=pomalidomide-dexamethasone; VMP=bortezomib-melphalan-prednisone; VTd=bortezomib-thalidomide-dexamethasone.
Tan huyết
Có nguy cơ tan huyết về mặt lý thuyết. Sẽ thực hiện theo dõi liên tục dấu hiệu an toàn này trong các nghiên cứu lâm sàng và dữ liệu an toàn sau khi thuốc lưu hành.
Nhóm dân số đặc biệt khác
Trong nghiên cứu Pha III MMY3007 so sánh điều trị D-VMP với điều trị VMP ở bệnh nhân đa u tủy mới chẩn đoán mà không phù hợp để ghép tế bào gốc tự thân, phân tích an toàn trên phân nhóm bệnh nhân có điểm thể trạng ECOG 2 (D-VMP: n=89, VMP: n=84) là nhất quán với dân số chung.
Người cao tuổi
Trong số 2459 bệnh nhân dùng DARZALEX liều khuyến cáo, 38% bệnh nhân từ 65 đến 75 tuổi, và 15% bệnh nhân từ 75 tuổi trở lên. Nhìn chung,không quan sát thấy sự khác biệt về hiệu quả dựa theo tuổi bệnh nhân. Tỷ lệ các phản ứng có hại nghiêm trọng ở những bệnh nhân cao tuổi cao hơn những bệnh nhân trẻ tuổi hơn. Trong số các bệnh nhân đa u tủy tái phát và kháng trị (n=1213), các phản ứng có hại nghiêm trọng phổ biến nhất xảy ra thường xuyên hơn ở nhóm người cao tuổi (≥65 tuổi) là viêm phổi và nhiễm trùng huyết. Trong số các bệnh nhân mới chẩn đoán đa u tuỷ không thích hợp với ghép tế bào gốc tự thân (n=710), phản ứng có hại nghiêm trọng phổ biến nhất thường gặp hơn ở người cao tuổi (≥75 tuổi) là viêm phổi.
Báo cáo các trường hợp nghi ngờ phản ứng có hại
Báo cáo các trường hợp nghi ngờ phản ứng có hại sau khi cấp phép lưu hành sản phẩm là rất quan trọng. Điều này cho phép tiếp tục theo dõi cân bằng lợi ích/nguy cơ của sản phẩm. Các cán bộ y tế được yêu cầu báo cáo bất kỳ trường hợp nghi ngờ phản ứng có hại nào thông qua hệ thống báo cáo quốc gia.
Thông báo ngay cho bác sĩ hoặc dược sĩ những phản ứng có hại gặp phải khi sử dụng thuốc.
6. Lưu ý |
– Thận trọng khi sử dụngTruy xuất Để cải thiện khả năng truy xuất các thuốc sinh học, cần ghi rõ tên thuốc và số lô thuốc được sử dụng. Các phản ứng liên quan đến truyền thuốc
Giảm bạch cầu trung tính/Giảm tiểu cầu
Ảnh hưởng đến xét nghiệm kháng globulin gián tiếp (xét nghiệm Coombs gián tiếp)
Ảnh hưởng đến việc xác định đáp ứng hoàn toàn Daratumumab là một kháng thể đơn dòng IgG kappa người, có thể được phát hiện trên cả hai phương pháp, xét nghiệm điện di protein huyết thanh (serum protein electrophoresis – SPE) và xét nghiệm cố định miễn dịch (IFE) mà được sử dụng để theo dõi trên lâm sàng protein-M nội sinh (xem phần 4.5). Sự tác động này có thể ảnh hưởng đến việc xác định đáp ứng hoàn toàn và tiến triển của bệnh ở một số bệnh nhân có protein u tủy IgG kappa. Tái hoạt hóa virus viêm gan B (HBV)
Tá dược Mỗi lọ DARZALEX 5 mL và 20 mL chứa 0,4 mmol và 1,6 mmol (tương ứng với 9,3 mg và 37,3 mg) natri. Lượng natri này tương ứng với 0,46% và 1,86% liều khuyến cáo tối đa mỗi ngày theo WHO là 2 g natri ở người lớn. – Thai kỳ và cho con búPhụ nữ có khả năng mang thai/Tránh thai Phụ nữ có khả năng mang thai nên sử dụng biện pháp tránh thai hiệu quả trong quá trình sử dụng và cho đến 3 tháng sau khi ngừng sử dụng daratumumab. Mang thai Không có dữ liệu trên người hoặc động vật để đánh giá nguy cơ sử dụng daratumumab trong thời kỳ mang thai. Các kháng thể đơn dòng IgG1 được biết là đi qua nhau thai sau quý đầu của thai kỳ. Do đó, không nên dùng daratumumab trong thời kỳ mang thai trừ khi lợi ích điều trị đối với người phụ nữ được xem là lớn hơn nguy cơ tiềm ẩn đối với phôi thai. Nếu bệnh nhân có thai trong khi dùng thuốc này, cần thông báo cho bệnh nhân về nguy cơ tiềm ẩn đối với phôi thai. Cho con bú
Khả năng sinh sản Hiện chưa có dữ liệu để xác định tác động tiềm tàng của daratumumab đối với khả năng sinh sản ở nam giới hoặc nữ giới. – Khả năng lái xe và vận hành máy mócDARZALEX không có hoặc có ảnh hưởng không đáng kể đến khả năng lái xe và sử dụng máy móc. Tuy nhiên, mệt mỏi đã được báo cáo ở những bệnh nhân dùng daratumumab và điều này nên được lưu ý khi lái xe hoặc sử dụng máy móc. – Tương tác thuốcKhông có nghiên cứu về tương tác thuốc nào được thực hiện. Là một kháng thể đơn dòng IgG1k, bài tiết qua thận và sự chuyển hóa qua trung gian enzyme gan của daratumumab dạng nguyên vẹn, dường như không đại diện cho các con đường thải trừ chủ yếu. Như vậy, những khác biệt trong các enzyme chuyển hóa thuốc được cho là không ảnh hưởng đến việc thải trừ daratumumab. Do ái lực cao với một epitope duy nhất trên CD38, không dự kiến daratumumab làm thay đổi các enzyme chuyển hóa thuốc. Đánh giá dược động học lâm sàng của daratumumab kết hợp với lenalidomide, pomalidomide, thalidomide, bortezomib và dexamethasone cho thấy không có tương tác thuốc – thuốc có ý nghĩa lâm sàng giữa daratumumab và các thuốc phân tử nhỏ phối hợp này. Tác động trên xét nghiệm kháng globulin gián tiếp (xét nghiệm Coombs gián tiếp) Daratumumab gắn với CD38 trên hồng cầu và gây tác động lên xét nghiệm khả năng tương thích, bao gồm sàng lọc kháng thể và ghép chéo. Các phương pháp giảm thiểu tác động của daratumumab bao gồm xử lý bằng chất phản ứng RBC với dithiothreitol (DTT) để phá vỡ liên kết daratumumab hoặc các phương pháp khác đã được thẩm định tại địa phương. Vì hệ thống nhóm máu Kell cũng nhạy cảm với việc dùng DTT nên các đơn vị Kell- âm tính nên được cung cấp sau khi loại trừ hoặc xác định các kháng thể đồng loại, sử dụng RBC đã được xử lý bằng DTT. Ngoài ra, cũng có thể xem xét thay thế bằng kiểu hình hoặc kiểu gen. Ảnh hưởng tới xét nghiệm Điện di Protein trong huyết thanh và miễn dịch cố định Daratumumab có thể được phát hiện trên xét nghiệm điện di protein huyết thanh (SPE) và xét nghiệm miễn dịch cố định (IFE) sử dụng để theo dõi các globulin miễn dịch đơn dòng bệnh lý (protein M). Điều này có thể dẫn đến các kết quả SPE và IFE dương tính giả đối với các bệnh nhân có protein u tủy IgG kappa, ảnh hưởng đến việc đánh giá ban đầu về đáp ứng hoàn toàn bằng các tiêu chuẩn của Nhóm làm việc quốc tế về đa u tủy xương (International Myeloma Working Group – IMWG). Ở những bệnh nhân có đáp ứng một phần rất tốt kéo dài mà nghi ngờ do tác động của daratumumab, cân nhắc sử dụng xét nghiệm IFE đặc hiệu cho daratumumab để phân biệt daratumumab với bất kỳ protein M nội sinh khác trong huyết thanh bệnh nhân, để thuận lợi xác định đáp ứng hoàn toàn. |
7. Dược lý
– Dược lực học (Tác động của thuốc lên cơ thể)
Nhóm dược lý điều trị: Các thuốc chống khối u, các kháng thể đơn dòng.
Mã ATC: L01XC24.
Cơ chế tác dụng
- Daratumumab là một kháng thể đơn dòng IgG1κ của người (mAb) gắn với protein CD38 biểu hiện ở nồng độ cao trên bề mặt các tế bào khối u của đa u tủy, cũng như các loại tế bào và mô khác với các nồng độ khác nhau. Protein CD38 có nhiều chức năng như là bám dính, phát tín hiệu và hoạt tính enzyme qua trung gian thụ thể.
- Daratumumab đã cho thấy khả năng ức chế mạnh sự phát triển in vivo của các tế bào khối u có biểu hiện CD38. Dựa trên các nghiên cứu in vitro, daratumumab có thể sử dụng nhiều chức năng phản ứng với kích thích, dẫn đến sự chết tế bào khối u qua trung gian miễn dịch. Các nghiên cứu này cho thấy daratumumab có thể gây ra sự ly giải tế bào khối u thông qua cơ chế độc tế bào phụ thuộc bổ thể, độc tế bào qua trung gian tế bào phụ thuộc kháng thể, và thực bào tế bào phụ thuộc kháng thể ở các khối u ác tính có biểu hiện CD38. Một phân nhóm các tế bào ức chế có nguồn gốc dòng tủy (CD38 + MDSC), các tế bào T điều hòa (CD38 + Tregs) và tế bào B (CD38 + Bregs) bị giảm bởi sự ly giải tế bào qua trung gian daratumumab. Các tế bào T (CD3+, CD4+, và CD8+) cũng được biết có biểu hiện CD38 tùy thuộc vào giai đoạn phát triển và mức độ hoạt hóa. Đã quan sát thấy sự gia tăng đáng kể số lượng các tế bào T CD4+ và CD8+ và tỷ lệ phần trăm lympho bào trong máu ngoại biên toàn phần và tủy xương khi điều trị bằng daratumumab. Ngoài ra, trình tự ADN thụ thể tế bào T đã xác nhận rằng dòng tế bào T tăng lên khi điều trị bằng daratumumab, cho thấy các tác dụng điều hòa miễn dịch có thể đóng góp vào đáp ứng lâm sàng.
- Daratumumab gây ra sự chết theo chương trình trên in vitro sau liên kết chéo qua trung gian Fc. Ngoài ra, daratumumab điều hòa hoạt tính enzyme của CD38, ức chế hoạt tính của enzyme cyclase và kích thích hoạt động hydrolase. Chưa hiểu rõ tầm quan trọng của những tác dụng in vitro này trên lâm sàng và liên quan đến tăng trưởng khối u.
Các tác dụng dược lực học
Số lượng tế bào giết tự nhiên (Natural killer -NK) và tế bào T
Các tế bào NK được biết là biểu hiện nồng độ cao CD38 và dễ bị ly giải tế bào qua trung gian daratumumab. Đã quan sát thấy số lượng tuyệt đối và tỷ lệ phần trăm của tổng số tế bào NK (CD16+ CD56+) và các tế bào NK hoạt hóa (CD16+ CD56dim) giảm trong máu toàn phần ngoại vi và tủy xương khi điều trị bằng daratumumab. Tuy nhiên, số lượng tế bào NK trước điều trị không cho thấy có liên quan đến đáp ứng lâm sàng.
Tính sinh miễn dịch
Ở các bệnh nhân đã điều trị bằng daratumumab đường tĩnh mạch trong các thử nghiệm lâm sàng, quan sát thấy dưới 1% bệnh nhân đã xuất hiện kháng thể kháng daratumumab do điều trị.
Hiệu quả và an toàn trên lâm sàng
Đa u tủy mới chẩn đoán
Điều trị kết hợp với lenalidomide và dexamethasone ở bệnh nhân không đạt tiêu chuẩn ghép tế bào gốc tự thân:
- Nghiên cứu MMY3008, một nghiên cứu pha III ngẫu nhiên, nhãn mở, có đối chứng với thuốc có hoạt tính so sánh điều trị DARZALEX 16 mg/kg kết hợp lenalidomide và dexamethasone liều thấp (DRd) với lenalidomide và dexamethasone liều thấp (Rd) ở bệnh nhân mới chẩn đoán đa u tuỷ. Lenalidomide (25 mg uống một lần mỗi ngày vào các Ngày 1-21 của các chu kỳ lặp lại 28 ngày [4-tuần]) dùng cùng với dexamethasone uống liều thấp hoặc đường tĩnh mạch 40 mg/tuần (hoặc giảm liều 20 mg/tuần cho bệnh nhân >75 tuổi hoặc chỉ số khối cơ thể [BMI] <18,5). Trong các ngày truyền DARZALEX, dexamethasone được dùng trước khi truyền. Điều chỉnh liều cho lenalidomide và dexamethasone được áp dụng theo thông tin kê toa của nhà sản xuất. Điều trị được tiếp tục ở cả hai nhánh cho đến khi bệnh tiến triển hoặc độc tính không chấp nhận được.
- Tổng số 737 bệnh nhân được phân ngẫu nhiên: 368 điều trị với DRd và 369 điều trị với Rd. Đặc tính nhân khẩu học và bệnh lý là tương tự giữa hai nhóm điều trị. Tuổi trung vị là 73 tuổi (khoảng: 45-90), với 44% bệnh nhân ≥75 tuổi. Đa số là da trắng (92%), nam giới (52%), 34% có điểm thể trạng ECOG là 0; 49,5% có điểm thể trạng ECOG là 1 và 17% có điểm thể trạng ECOG là ≥2. 27% có ISS Giai đoạn I, 43% có ISS Giai đoạn II và 29% có ISS Giai đoạn III. Hiệu quả được đánh giá bởi sống không tiến triển bệnh (PFS) dựa trên tiêu chuẩn của Nhóm Hoạt động về Bệnh U tủy Quốc tế (International Myeloma Working Group – IMWG).
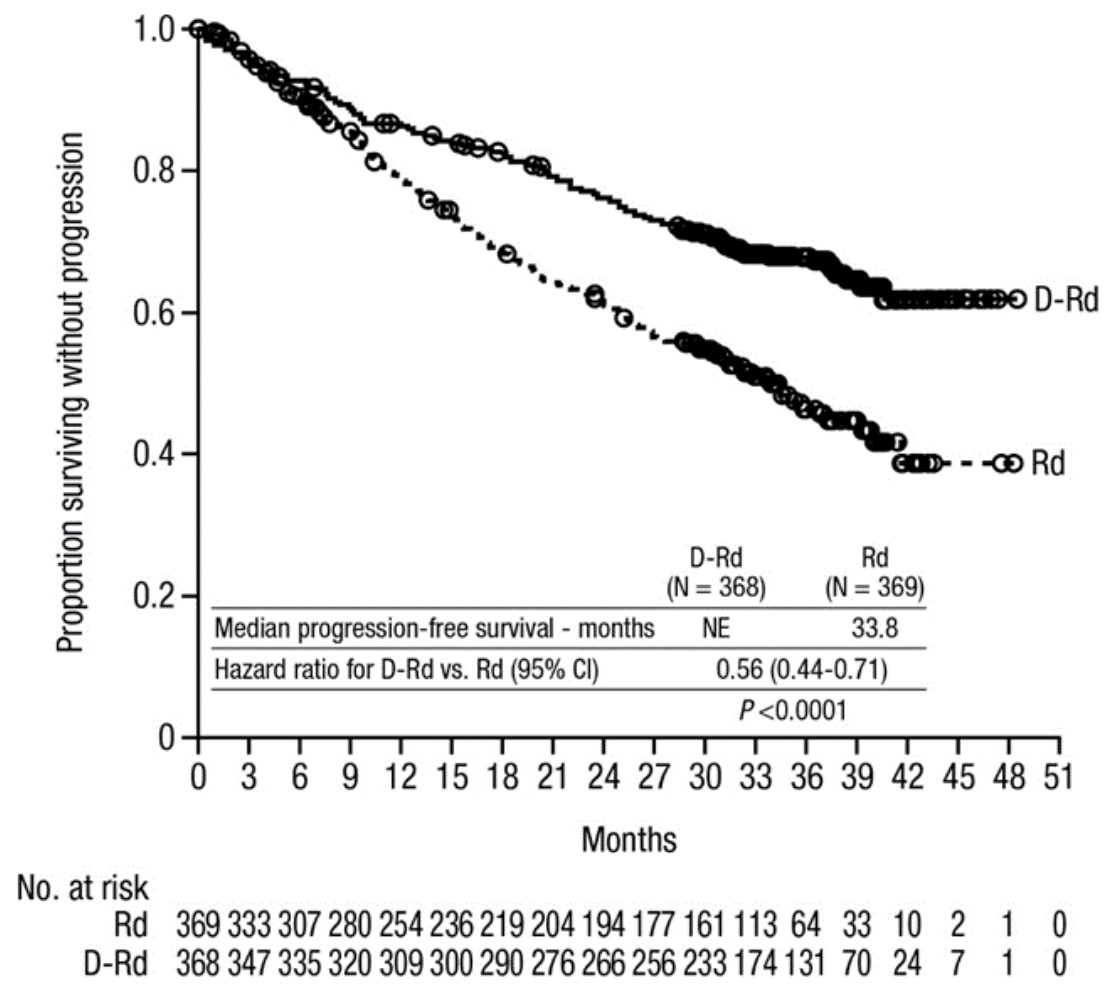
- Phân tích ban đầu về PFS trong Nghiên cứu MMY3008 cho thấy sự cải thiện trong nhóm DRd so với nhóm Rd; trung vị PFS là chưa đạt tới ở nhóm DRd và là 31,9 tháng ở nhóm Rd (tỷ số nguy hại [HR]= 0,56; 95% CI: 0,43; 0,73; p<0,0001), thể hiện giảm 44% nguy cơ bệnh tiến triển hoặc tử vong ở bệnh nhân điều trị với DRd. Kết quả của phân tích PFS cập nhật khoảng 9 tháng sau khi cutoff lâm sàng ban đầu tiếp tục cho thấy có cải thiện về PFS ở bệnh nhân nhóm DRd so với nhóm Rd. Trung vị PFS vẫn chưa đạt tới ở nhóm DRd và là 33,8 tháng ở nhóm Rd (HR=0,56; 95% CI: 0,44; 0,71; p<0,0001).
Hình 1: Đường cong Kaplan-Meier của sống không tiến triển bệnh (PFS) trong Nghiên cứu MMY3008.
Các kết quả bổ sung về hiệu quả từ Nghiên cứu MMY3008 được trình bày trong Bảng 7 dưới đây.
Bảng 7: Kết quả bổ sung về hiệu quả từ Nghiên cứu MMY3008a.
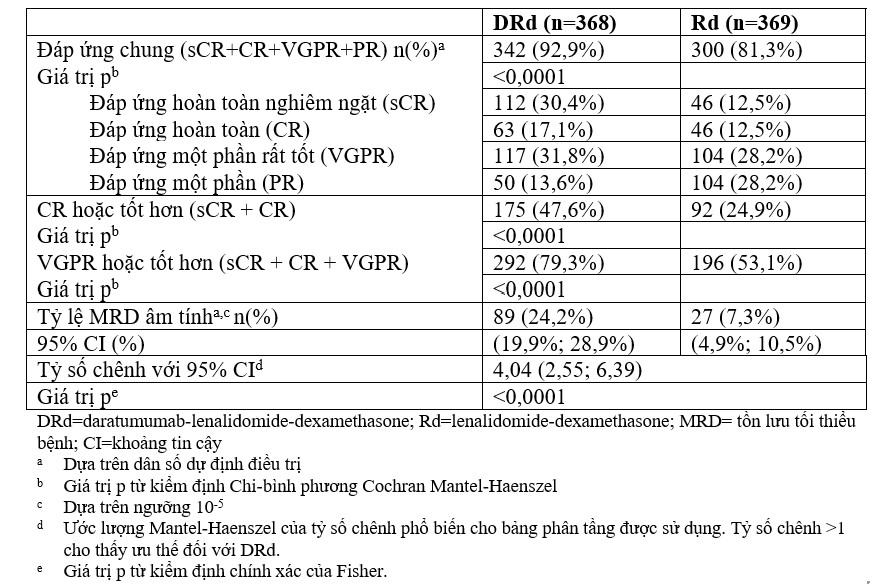
Trong số bệnh nhân đáp ứng, trung vị thời gian đến đáp ứng là 1,05 tháng (khoảng: 0,2 đến 12,1 tháng) cho nhóm DRd và 1,05 tháng (khoảng: 0,3 đến 15,3 tháng) cho nhóm Rd. Trung vị thời gian đến khi đáp ứng là chưa đạt tới cho nhóm DRd và là 34,7 tháng (95% CI: 30,8, không ước lượng được) cho nhóm Rd.
Điều trị kết hợp với bortezomib, melphalan và prednisone (VMP) ở bệnh nhân không đạt tiêu chuẩn ghép tế bào gốc tự thân:
Nghiên cứu MMY3007, một nghiên cứu pha III ngẫu nhiên, nhãn mở, có đối chứng so sánh điều trị DARZALEX 16 mg/kg kết hợp bortezomib, melphalan và prednisone (D-VMP) với điều trị VMP ở bệnh nhân mới chẩn đoán đa u tủy. Bortezomib liều 1,3 mg/m2 diện tích bề mặt cơ thể được tiêm dưới da hai lần mỗi tuần vào Tuần 1, 2, 4 và 5 cho chu kỳ 6 tuần đầu tiên (Chu kỳ 1; 8 liều), tiếp nối bởi một lần mỗi tuần vào Tuần 1, 2, 4 và 5 cho tám chu kỳ 6 tuần (Chu kỳ 2-9; 4 liều mỗi chu kỳ). Melphalan liều 9 mg/m2, và prednisone liều 60 mg/m2 dùng đường uống vào Ngày 1 đến 4 của chín chu kỳ 6 tuần (Chu kỳ 1-9). Điều trị DARZALEX liên tục cho đến khi bệnh tiến triển hoặc độc tính không chấp nhận được.
Tổng số 706 bệnh nhân được phân ngẫu nhiên: 350 điều trị với D-VMP và 356 điều trị với VMP. Đặc tính nhân khẩu học và bệnh lý là tương tự giữa hai nhóm điều trị. Tuổi trung vị là 71 tuổi (khoảng: 40-93), với 30% bệnh nhân ≥75 tuổi. Đa số là da trắng (85%), phụ nữ (54%), 25% có điểm thể trạng ECOG là 0, 50% có điểm thể trạng ECOG là 1 và 25% có điểm thể trạng ECOG là 2. Bệnh nhân có u tủy IgG/IgA/Chuỗi nhẹ trong 64%/22%/10% trường hợp, 19% có ISS Giai đoạn I, 42% có ISS Giai đoạn II, 38% có ISS Giai đoạn III và 84% có nguy cơ chuẩn về di truyền tế bào. Hiệu quả được đánh giá bởi sống không tiến triển bệnh (PFS) dựa trên tiêu chuẩn của Nhóm Hoạt động về Bệnh U tủy Quốc tế (International Myeloma Working Group – IMWG) và sống còn toàn bộ (OS).
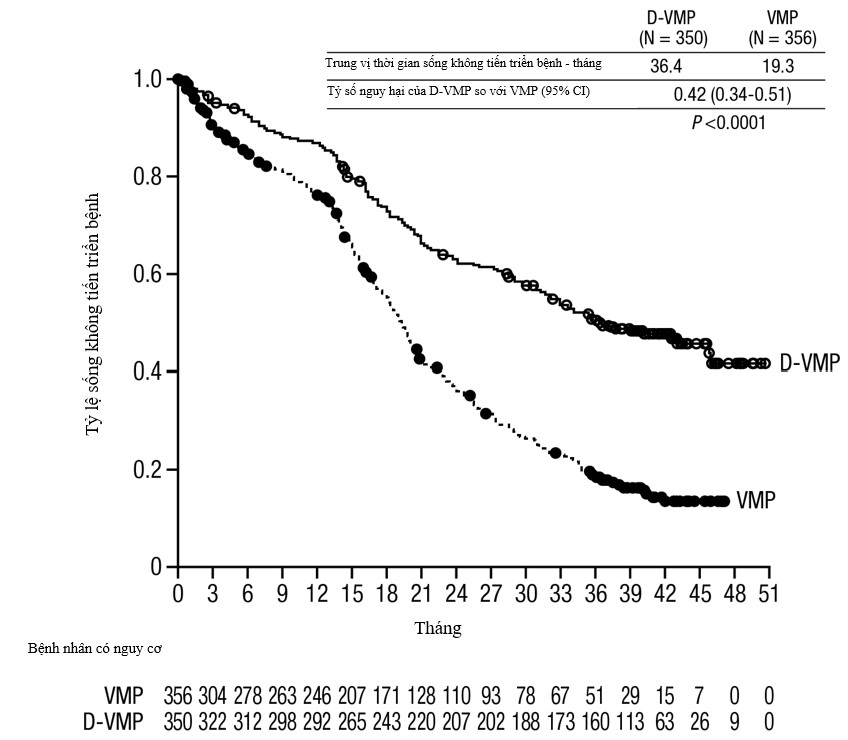
Với trung vị theo dõi 16,5 tháng, phân tích ban đầu về PFS trong Nghiên cứu MMY3007 cho thấy sự cải thiện trong nhóm D-VMP so với nhóm VMP; trung vị PFS là chưa đạt tới ở nhóm D-VMP và là 18,1 tháng ở nhóm VMP (HR=0,5; 95% CI: 0,38; 0,65; p<0,0001). Kết quả của phân tích PFS cập nhật sau trung vị theo dõi 40 tháng tiếp tục cho thấy có cải thiện về PFS ở bệnh nhân nhóm D-VMP so với nhóm VMP. Trung vị PFS là 36,4 tháng ở nhóm D-VMP và 19,3 tháng ở nhóm VMP (HR=0,42; 95% CI: 0,34;0,51; p<0,0001), cho thấy giảm 58% nguy cơ bệnh tiến triển hoặc tử vong ở những bệnh nhân điều trị với D-VMP.
Hình 2: Đường cong Kaplan-Meier của sống không tiến triển bệnh (PFS) trong Nghiên cứu MMY3007.
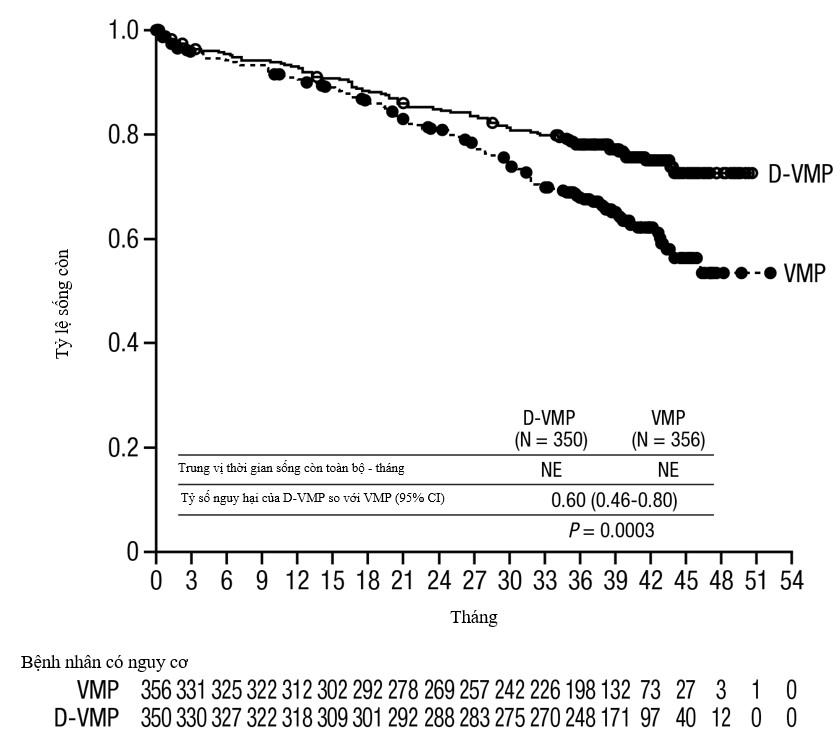
Sau trung vị theo dõi 40 tháng, quan sát thấy tỷ lệ sống còn toàn bộ ưu thế hơn ở nhóm D‑VMP so với nhóm VMP (HR=0,60; 95% CI: 0,46; 0,80; p=0,0003), cho thấy giảm 40% nguy cơ tử vong ở những bệnh nhân đã điều trị trong nhóm D‑VMP arm. Trung vị sống còn toàn bộ chưa đạt tới ở mỗi nhóm.
Hình 3: Đường cong Kaplan-Meier của sống còn toàn bộ (OS) trong Nghiên cứu MMY3007.
Các kết quả bổ sung về hiệu quả từ nghiên cứu MMY3007 được trình bày trong Bảng 8 dưới đây.
Bảng 8: Kết quả bổ sung về hiệu quả từ Nghiên cứu MMY3007a.
| D-VMP (n=350) | VMP (n=356) |
Đáp ứng chung (sCR+CR+VGPR+PR) [n(%)] | 318 (90,9) | 263 (73,9) |
Giá trị pb | <0,0001 |
|
Đáp ứng hoàn toàn nghiêm ngặt (sCR) [n(%)] | 63 (18,0) | 25 (7,0) |
Đáp ứng hoàn toàn (CR) [n(%)] | 86 (24,6) | 62 (17,4) |
Đáp ứng một phần rất tốt (VGPR) [n(%)] | 100 (28,6) | 90 (25,3) |
Đáp ứng một phần (PR) [n(%)] | 69 (19,7) | 86 (24,2) |
Tỷ lệ MRD âm tính (95% CI) c (%) | 22,3 (18,0; 27,0) | 6,2 (3,9; 9,2) |
Tỷ số chênh với 95% CId | 4,36 (2,64; 7,21) |
|
Giá trị pe | <0,0001 |
|
D-VMP=daratumumab-bortezomib-melphalan-prednisone; VMP=bortezomib-melphalan-prednisone; MRD= tồn lưu tối thiểu bệnh; CI=khoảng tin cậy.
a Dựa trên dân số dự định điều trị.
b Giá trị p từ kiểm định Chi-bình phương Cochran Mantel-Haenszel.
c Dựa trên ngưỡng 10-5.
d Ước lượng Mantel-Haenszel của tỷ số chênh phổ biến cho bảng phân tầng được sử dụng. Tỷ số chênh >1 cho thấy ưu thế đối với D-VMP.
e Giá trị p từ kiểm định chính xác của Fisher.
Trong số bệnh nhân đáp ứng, trung vị thời gian đến đáp ứng là 0,79 tháng (khoảng: 0,4 đến 15,5 tháng) cho nhóm D-VMP và 0,82 tháng (khoảng: 0,7 đến 12,6 tháng) cho nhóm VMP. Trung vị thời gian đến khi đáp ứng là chưa đạt tới cho nhóm D-VMP và là 21,3 tháng (khoảng: 18,4, không ước lượng được) cho nhóm VMP.
Một phân tích dưới nhóm đã được thực hiện trên bệnh nhân ít nhất 70 tuổi, hoặc bệnh nhân 65-69 tuổi với điểm thể trạng ECOG là 2, hoặc bệnh nhân dưới 65 tuổi với kết hợp nhiều bệnh đáng kể hoặc điểm thể trạng ECOG là 2 (D-VMP: n=273, VMP: n=270). Kết quả về hiệu quả trong phân nhóm này là nhất quán với nhóm dân số chung. Trong phân nhóm này, trung vị PFS là chưa đạt tới cho nhóm D-VMP và là 17,9 tháng cho nhóm VMP (HR=0,56; 95% CI: 0,42; 0,75); p<0,0001). Tỷ lệ đáp ứng chung là 90% cho nhóm D-VMP và 74% cho nhóm VMP (tỷ lệ VGPR: 29% cho nhóm D‑VMP và 26% cho nhóm VMP; CR: 22% cho nhóm D‑VMP và 18% cho nhóm VMP; tỷ lệ sCR: 20% cho nhóm D‑VMP và 7% cho nhóm VMP). Kết quả về an toàn ở phân nhóm này là nhất quán với dân số chung. Hơn nữa, phân tích về an toàn của phân nhóm bệnh nhân có điểm thể trạng ECOG là 2 (D-VMP: n=89, VMP: n=84) cũng thể hiện sự nhất quán với dân số chung.
Phối hợp điều trị với bortezomib, thalidomide và dexamethasone (VTd) ở bệnh nhân đủ điều kiện ghép tế bào gốc tự thân (ASCT):
Nghiên cứu MMY3006 là một nghiên cứu Pha III, ngẫu nhiên, nhãn mở, có đối chứng với thuốc có hoạt tính, gồm 2 phần. Phần 1 so sánh việc điều trị tấn công và củng cố của DARZALEX 16 mg/kg kết hợp với bortezomib, thalidomide và dexamethasone (D-VTd) so với điều trị với bortezomib, thalidomide và dexamethasone (VTd) ở bệnh nhân mới chẩn đoán đa u tủy đủ điều kiện ghép tế bào gốc tự thân. Pha củng cố điều trị được khởi đầu ít nhất 30 ngày sau khi ghép tế bào gốc tự thân, khi bệnh nhân đã hồi phục và hoàn tất mọc mảnh ghép. Ở phần 2, các đối tượng ít nhất đạt đáp ứng một phần (PR) vào ngày 100 sau ghép đã được tái chọn lựa ngẫu nhiên với tỷ lệ 1:1 vào nhóm duy trì với daratumumab hoặc chỉ quan sát. Chỉ có kết quả từ phần 1 được miêu tả từ đây trở đi.
Bortezomib được tiêm dưới da hoặc tiêm tĩnh mạch với liều 1,3 mg/m2 diện tích bề mặt cơ thể 2 lần/tuần trong hai tuần (Ngày 1, 4, 8 và 11) của chu kỳ điều trị tấn công lặp lại 28 ngày (4 tuần) (Chu kỳ 1-4) và hai chu kỳ điều trị củng cố (Chu kỳ 5 và 6) tiếp theo ghép tế bào gốc tự thân sau Chu kỳ 4. Thalidomide được dùng đường uống với liều 100 mg/ngày trong sáu chu kỳ bortezomib. Dexamethasone (uống hay tiêm tĩnh mạch) được dùng với liều 40 mg vào Ngày 1, 2, 8, 9, 15, 16, 22 và 23 của Chu kỳ 1 và 2, và với liều 40 mg vào Ngày 1-2 và 20 mg vào các ngày sau đó (Ngày 8, 9, 15, 16) của Chu kỳ 3-4. Dexamethasone 20 mg được dùng vào Ngày 1, 2, 8, 9, 15, 16 của Chu kỳ 5 và 6. Vào ngày truyền DARZALEX, liều dexamethasone được dùng đường tĩnh mạch trước khi truyền. Việc điều chỉnh liều bortezomib, thalidomide và dexamethasone được áp dụng theo thông tin kê đơn của nhà sản xuất.
Tổng số 1085 bệnh nhân được phân ngẫu nhiên: 543 bệnh nhân điều trị với D-VTd và 542 bệnh nhân điều trị với VTd. Đặc tính nhân khẩu học và bệnh lý là tương tự giữa hai nhóm điều trị. Trung vị tuổi là 58 (khoảng: 22 đến 65) tuổi. Tất cả bệnh nhân đều ≤65 tuổi: 43% trong nhóm ≥60-65 tuổi, 41% trong nhóm ≥50-60 tuổi và 16% dưới 50 tuổi. Đa số là nam giới (59%), 48% có điểm thể trạng ECOG là 0, 42% có điểm thể trạng ECOG là 1 và 10% điểm thể trạng ECOG là 2. Bốn mươi phần trăm có ISS Giai đoạn I, 45% có ISS Giai đoạn II và 15% có ISS Giai đoạn III.
Hiệu quả được đánh giá bởi tỷ lệ Đáp ứng hoàn toàn nghiêm ngặt (sCR) vào Ngày 100 sau cấy ghép và Sống không tiến triển bệnh (PFS).
Bảng 9: Kết quả về hiệu quả từ Nghiên cứu MMY3006a.
| D-VTd (n=543) | VTd (n=542) | Giá trị Pb |
Đánh giá đáp ứng Ngày 100 sau cấy ghép |
|
|
|
Đáp ứng hoàn toàn nghiêm ngặt (sCR) | 157 (28,9%) | 110 (20,3%) | 0,0010 |
CR hoặc tốt hơn (sCR+CR) | 211 (38,9%) | 141 (26,0%) | <0,0001 |
Đáp ứng một phần rất tốt hoặc tốt hơn (sCR+CR+VGPR) | 453 (83,4%) | 423 (78,0%) |
|
MRD âm tínhc, d n(%) | 346 (63,7%) | 236 (43,5%) | <0,0001 |
95% CI (%) | (59,5%; 67,8%) | (39,3%; 47,8%) |
|
Tỷ số chênh với 95% CIe | 2,27 (1,78; 2,90) |
| |
MRD âm tính kết hợp với CR hoặc tốt hơnc n(%) | 183 (33,7%) | 108 (19,9%) | <0,0001 |
95% CI (%) | (29,7%; 37,9%) | (16,6%; 23,5%) |
|
Tỷ số chênh với 95% CIe | 2,06 (1,56; 2,72) |
| |
D-VTd=daratumumab-bortezomib-thalidomide-dexamethasone; VTd=bortezomib-thalidomide-dexamethasone; MRD= tồn lưu tối thiểu bệnh; CI=khoảng tin cậy.
a Dựa trên dân số dự định điều trị.
b Giá trị p từ kiểm định Chi-bình phương Cochran Mantel-Haenszel.
c Dựa trên ngưỡng 10-5.
d Bất kể đáp ứng theo IMWG.
e Ước lượng Mantel-Haenszel của tỷ số chênh phổ biến cho bảng phân tầng được sử dụng.
Kết quả của một phân tích Sống không tiến triển bệnh trên các bệnh nhân được kiểm định (censoring patients) mà họ được chọn ngẫu nhiên vào nhóm dùng daratumumab duy trì trong lần phân ngẫu nhiên thứ hai, tại ngày của lần dùng ngẫu nhiên thứ hai cho thấy HR=0.50; 95% CI: 0,34; 0,75; p=0,0005.
Đa u tủy kháng trị/Tái phát
Đơn trị liệu:
- Có hai nghiên cứu nhãn mở chứng minh hiệu quả và an toàn trên lâm sàng của DARZALEX đơn trị liệu để điều trị bệnh nhân người lớn bị đa u tủy tái phát và kháng trị, những người trước đó được điều trị bằng phác đồ có một chất ức chế proteasome và một thuốc điều hòa miễn dịch và những người đã có tiến triển bệnh rõ ràng trong liệu trình điều trị cuối.
- Trong Nghiên cứu MMY2002, 106 bệnh nhân bị đa u tủy tái phát và kháng trị đã dùng DARZALEX 16 mg/kg cho đến khi bệnh tiến triển. Trung vị tuổi của bệnh nhân là 63,5 tuổi (khoảng: 31 đến 84 tuổi), 11% bệnh nhân ≥ 75 tuổi, 49% là nam giới và 79% là người da trắng. Các bệnh nhân đã dùng trung vị 5 phác đồ trị liệu trước đó. Tám mươi phần trăm bệnh nhân đã được ghép tế bào gốc tự thân (ASCT) trước đó. Các trị liệu trước đó bao gồm bortezomib (99%), lenalidomide (99%), pomalidomide (63%) và carfilzomib (50%). Tại thời điểm ban đầu, 97% bệnh nhân đã kháng lại phác đồ điều trị cuối cùng, 95% kháng với cả hai thuốc, một chất ức chế proteasome (PI) và thuốc điều hòa miễn dịch (IMiD), 77% kháng với các thuốc alkyl hóa, 63% kháng với pomalidomide và 48% bệnh nhân kháng với carfilzomib.
- Kết quả về hiệu quả của phân tích tạm thời theo kế hoạch dựa trên đánh giá của Ủy ban Đánh giá độc lập (Independent Review Committee -IRC) được trình bày trong Bảng 10 dưới đây.
Bảng 10: IRC đánh giá các kết quả về hiệu quả trong nghiên cứu MMY2002.
Các tiêu chí hiệu quả | DARZALEX 16 mg/kg N = 106 |
Tỷ lệ đáp ứng chung1 (ORR: sCR+CR+VGPR+PR) [n (%)] | 31 (29,2) |
95% CI (%) | (20,8; 38,9) |
Đáp ứng hoàn toàn nghiêm ngặt (sCR) [n (%)] | 3 (2,8) |
Đáp ứng hoàn toàn (CR) [n] | 0 |
Đáp ứng một phần rất tốt (VGPR) [n (%)] | 10 (9,4) |
Đáp ứng một phần (PR) [n (%)] | 18 (17,0) |
Tỷ lệ có lợi ích lâm sàng (ORR+MR) [n (%)] | 36 (34,0) |
Trung vị khoảng thời gian đạt đáp ứng [tháng (95% CI)] | 7,4 (5,5; NE) |
Trung vị thời gian đến khi đạt đáp ứng [tháng (khoảng)] | 1 (0,9; 5,6) |
1 Tiêu chí hiệu quả chính (tiêu chí của International Myeloma Working Group);
CI = khoảng tin cậy; NE = không ước lượng được; MR = đáp ứng tối thiểu.
Tỷ lệ đáp ứng chung (ORR) trong MMY2002 tương tự nhau bất kể loại liệu pháp chống u tủy được điều trị trước đó.
Trong một báo cáo cập nhật về sống còn với trung vị thời gian theo dõi là 14,7 tháng, trung vị thời gian sống còn toàn bộ (Overall Survival – OS) là 17,5 tháng (95% CI: 13,7, không ước lượng được).
Trong nghiên cứu GEN501, 42 bệnh nhân đa u tủy tái phát và kháng trị được dùng DARZALEX 16 mg/kg cho đến khi tiến triển bệnh. Trung vị tuổi của bệnh nhân là 64 tuổi (khoảng: 44 đến 76 tuổi), 64% là nam giới và 76% là người da trắng. Bệnh nhân trong nghiên cứu đã nhận được trung vị 4 phác đồ điều trị trước đó. Bảy mươi bốn phần trăm bệnh nhân đã nhận ASCT trước đó. Các liệu pháp trước đó bao gồm bortezomib (100%), lenalidomide (95%), pomalidomide (36%) và carfilzomib (19%). Ở thời điểm ban đầu, 76% bệnh nhân kháng với phác đồ điều trị cuối cùng, 64% kháng cả PI và IMiD, 60% kháng với các tác nhân alkyl hóa, 36% kháng với pomalidomide và 17% kháng với carfilzomib.
Phân tích giữa kỳ theo kế hoạch định trước cho thấy điều trị bằng daratumumab ở liều 16 mg/kg dẫn đến ORR 36% với 5% CR và 5% VGPR. Trung vị thời gian đến khi đạt đáp ứng là 1 tháng (khoảng: 0,5 đến 3,2). Trung vị khoảng thời gian đạt đáp ứng chưa đạt tới (95% CI: 5,6 tháng, không ước lượng được).
Tại thời điểm cập nhật về thời gian sống còn với trung vị thời gian theo dõi là 15,2 tháng, trung vị của OS không tính được (95% CI: 19,9 tháng, không ước lượng được), 74% đối tượng còn sống.
Điều trị kết hợp với lenalidomide:
- Nghiên cứu MMY3003, một thử nghiệm pha III, ngẫu nhiên, nhãn mở, có đối chứng với thuốc có hoạt tính, so sánh điều trị DARZALEX 16 mg/kg kết hợp với lenalidomide và dexamethasone liều thấp (DRd) với điều trị bằng lenalidomide và dexamethasone liều thấp (Rd) trên các bệnh nhân đa u tủy tái phát hoặc kháng trị mà đã được điều trị ít nhất một phác đồ trước đó. Lenalidomide (25 mg uống một lần mỗi ngày vào các Ngày 1-21 của chu kỳ lặp lại 28-ngày [4-tuần]) được dùng cùng với dexamethasone liều thấp 40 mg/tuần (hoặc giảm liều 20 mg/tuần đối với bệnh nhân > 75 tuổi hoặc chỉ số khối cơ thể [BMI] <18,5). Vào các ngày truyền DARZALEX, đã dùng dexamethasone liều 20 mg trước khi truyền, và phần liều còn lại được dùng vào ngày sau khi truyền. Điều trị được tiếp tục ở cả hai nhánh cho đến khi tiến triển bệnh hoặc khi có độc tính không chấp nhận được.
- Tổng số có 569 bệnh nhân được phân ngẫu nhiên; 286 vào nhóm DRd và 283 vào nhóm Rd. Các đặc điểm nhân khẩu học và bệnh lý của bệnh nhân lúc ban đầu tương tự giữa nhóm dùng DARZALEX và nhóm đối chứng. Trung vị tuổi bệnh nhân là 65 tuổi (khoảng: 34 đến 89 tuổi) và 11% là ≥ 75 tuổi. Đa số bệnh nhân (86%) đã được điều trị bằng PI (proteasome inhibitor) trước đó, 55% bệnh nhân đã được dùng IMiD trước đó, bao gồm 18% bệnh nhân đã được điều trị lenalidomide trước đó; và 44% bệnh nhân đã được dùng cả PI và IMiD trước đó. Vào thời điểm ban đầu, 27% bệnh nhân kháng với trị liệu cuối cùng. Mười tám phần trăm (18%) bệnh nhân chỉ kháng với PI, và 21% là kháng với bortezomib. Các bệnh nhân kháng với điều trị lenalidomide bị loại trừ khỏi nghiên cứu.
- Với trung vị theo dõi 13,5 tháng, phân tích ban đầu về sống không tiến triển bệnh (PFS) trong nghiên cứu MMY3003 đã chứng minh sự cải thiện ở nhóm DRd so với nhóm Rd; trung vị PFS chưa đạt tới ở nhóm DRd và là 18,4 tháng ở nhóm Rd (HR = 0,37; 95% CI: 0,27; 0,52; p <0,0001). Các kết quả của phân tích PFS cập nhật sau trung vị theo dõi 55 tháng tiếp tục cho thấy cải thiện về PFS ở bệnh nhân nhóm DRd so với nhóm Rd. Trung vị PFS là 45,0 tháng ở nhóm DRd và 17,5 tháng ở nhóm Rd (HR=0,44; 95% CI: 0,35; 0,54; p<0,0001), thể hiện giảm 56% nguy cơ tiến triển bệnh hoặc tử vong ở bệnh nhân điều trị bằng DRd (xem Hình 4).
Hình 4: Đường cong Kaplan-Meier của sống không tiến triển bệnh (PFS) trong nghiên cứu MMY3003.
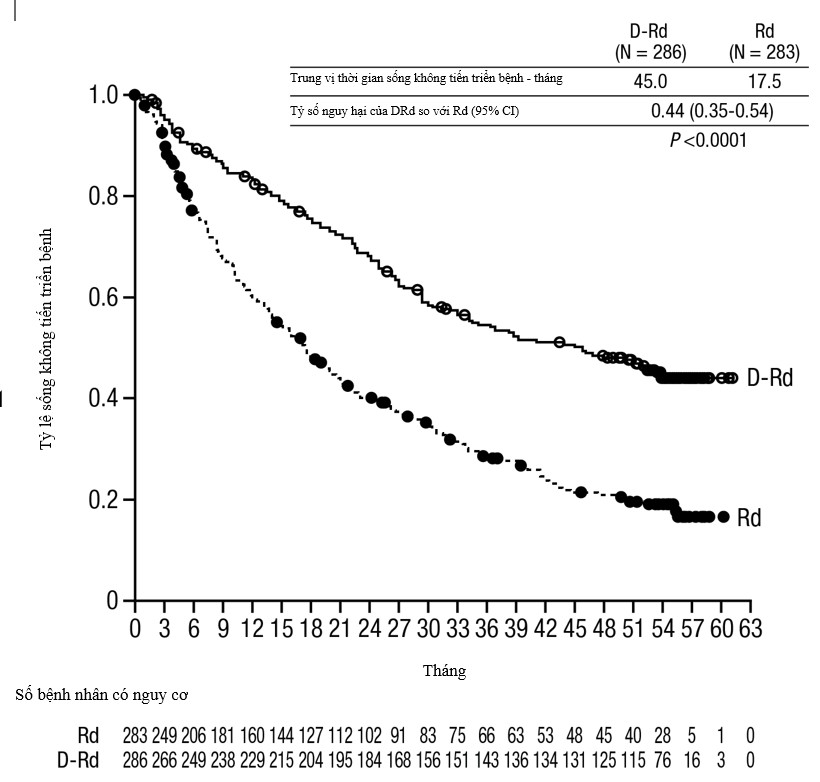
Các kết quả bổ sung về hiệu quả từ nghiên cứu MMY3003 được trình bày trong Bảng 11 dưới đây.
Bảng 11: Các kết quả bổ sung về hiệu quả từ nghiên cứu MMY3003.
Số bệnh nhân đánh giá được về đáp ứng | DRd (n = 281) | Rd (n = 276) |
Đáp ứng chung (sCR+CR+VGPR+PR) n (%) | 261 (92,9) | 211 (76,4) |
Giá trị pa | <0,0001 |
|
Đáp ứng hoàn toàn nghiêm ngặt (sCR) | 51 (18,1) | 20 (7,2) |
Đáp ứng hoàn toàn (CR) | 70 (24,9) | 33 (12,0) |
Đáp ứng một phần rất tốt (VGPR) | 92 (32,7) | 69 (25,0) |
Đáp ứng một phần (PR) | 48 (17,1) | 89 (32,2) |
Trung vị thời gian đến khi đạt đáp ứng [tháng (95% CI)] | 1,0 (1,0; 1,1) | 1,3 (1,1; 1,9) |
Trung vị khoảng thời gian đạt đáp ứng [tháng (95% CI)] | NE (NE, NE) | 17,4 (17,4; NE) |
Tỷ lệ MRD âm tính (95% CI) b (%) | 21,0 (16,4; 26,2) | 2,8 (1,2; 5,5) |
Tỷ suất chênh OR với 95% CIc | 9,31 (4,31; 20,09) |
|
Giá trị Pd | < 0,0001 |
|
DRd = daratumumab-lenalidomide-dexamethasone; Rd = lenalidomide-dexamethasone; MRD = tồn lưu tối thiểu bệnh; CI = khoảng tin cậy; NE = không ước lượng được.
a Giá trị p từ kiểm định Chi-bình phương Cochran Mantel-Haenszel.
b Dựa trên quần thể Dự định điều trị (Intent-to-treat-ITT) và ngưỡng 10-5.
c Sử dụng ước lượng Mantel‑Haenszel với tỷ suất chênh phổ biến. Một tỷ suất chênh OR > 1 cho thấy lợi thế của nhóm DRd.
d Giá trị p-từ kiểm định Fisher’s exact.
Trung vị OS chưa đạt tới ở cả hai nhóm điều trị. Với trung vị thời gian theo dõi chung là 13,5 tháng, tỷ số nguy hại đối với OS là 0,64 (95% CI: 0,40; 1,01; p = 0,0534).
Điều trị phối hợp với bortezomib:
- Nghiên cứu MMY3004, một thử nghiệm pha III, ngẫu nhiên, nhãn mở, có đối chứng với thuốc có hoạt tính, so sánh điều trị với DARZALEX 16 mg/kg kết hợp bortezomib và dexamethasone (DVd) với điều trị bằng bortezomib và dexamethasone (Vd) ở các bệnh nhân bị đa u tủy tái phát hoặc kháng trị mà đã được điều trị ít nhất một phác đồ trước đó. Bortezomib được dùng bằng đường tiêm dưới da hoặc truyền tĩnh mạch với liều 1,3 mg/m2 diện tích bề mặt cơ thể 2 lần mỗi tuần trong hai tuần (các Ngày 1, 4, 8 và 11) trong các chu kỳ điều trị lặp lại 21 ngày (3 tuần), trong tổng cộng 8 chu kỳ. Dexamethasone được dùng đường uống với liều 20 mg vào các Ngày 1, 2, 4, 5, 8, 9, 11 và 12 của mỗi chu kỳ trong 8 chu kỳ dùng bortezomib (80 mg/tuần trong hai tuần trong số ba tuần của chu kỳ bortezomib) hoặc liều giảm 20 mg/tuần cho bệnh nhân > 75 tuổi, BMI <18,5, đái tháo đường kiểm soát kém hoặc không dung nạp steroid trước đó. Vào những ngày truyền DARZALEX, dùng dexamethasone 20 mg trước khi truyền. Tiếp tục điều trị bằng DARZALEX đến khi bệnh tiến triển hoặc xuất hiện độc tính không chấp nhận được.
- Tổng số có 498 bệnh nhân được phân ngẫu nhiên; 251 vào nhóm DVd và 247 vào nhóm Vd. Các đặc điểm nhân khẩu học và bệnh lý ban đầu là tương tự giữa nhóm DARZALEX và nhóm đối chứng. Trung vị tuổi của bệnh nhân là 64 tuổi (khoảng từ 30 đến 88 tuổi) và 12% ≥ 75 tuổi. Sáu mươi chín phần trăm (69%) bệnh nhân đã được dùng PI trước đó (66% đã dùng bortezomib) và 76% bệnh nhân dùng IMiD (42% được dùng lenalidomide). Ở thời điểm khởi đầu, 32% bệnh nhân kháng với phác đồ trị liệu cuối cùng. Ba mươi ba phần trăm (33%) bệnh nhân chỉ kháng với một IMiD, và 28% kháng với lenalidomide. Bệnh nhân kháng với bortezomib đã được loại trừ khỏi nghiên cứu.
- Với trung vị theo dõi 7,4 tháng, phân tích ban đầu về sống không tiến triển bệnh (PFS) trong nghiên cứu MMY3004 đã chứng minh có sự cải thiện ở nhóm DVd so với nhóm Vd; trung vị PFS là chưa đạt tới ở nhóm DVd và là 7,2 tháng ở nhóm Vd (HR [95% CI]: 0,39 [0,28; 0,53], giá trị p <0,0001). Các kết quả của phân tích PFS cập nhật sau trung vị theo dõi 50 tháng tiếp tục cho thấy cải thiện về PFS ở bệnh nhân nhóm DVd so với nhóm Vd. Trung vị PFS là 16,7 tháng ở nhóm DVd và 7,1 tháng ở nhóm Vd (HR [95% CI]: 0,31 [0,24; 0,39]; p<0,0001), cho thấy giảm 69% nguy cơ tiến triển bệnh hoặc tử vong ở bệnh nhân điều trị bằng DVd so với Vd. (xem Hình 5).
Hình 5: Đường cong Kaplan-Meier của sống không tiến triển bệnh (PFS) trong nghiên cứu MMY3004.
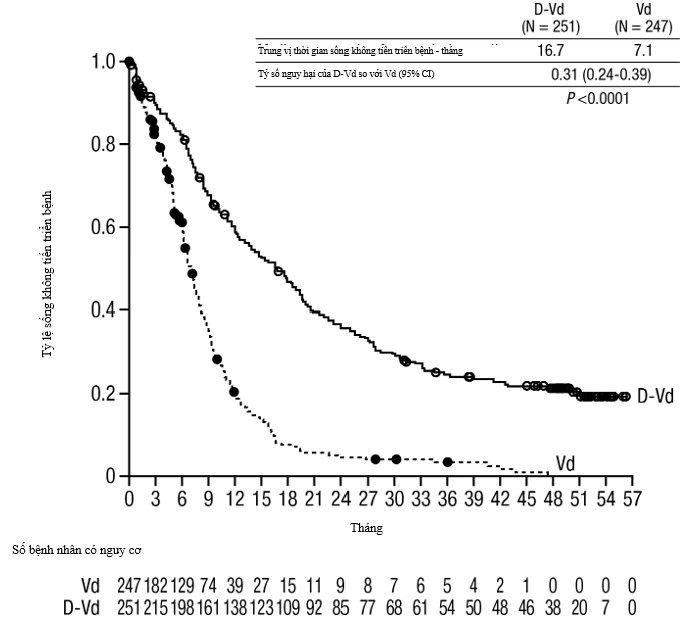
Các kết quả bổ sung về hiệu quả từ nghiên cứu MMY3004 được trình bày trong Bảng 12 dưới đây.
Bảng 12: Các kết quả bổ sung về hiệu quả từ nghiên cứu MMY3004.
Số bệnh nhân đánh giá được về đáp ứng | DVd (n = 240) | Vd (n = 234) |
Đáp ứng chung (sCR+CR+VGPR+PR) n (%) | 199 (82,9) | 148 (63,2) |
Giá trị Pa | <0,0001 |
|
Đáp ứng hoàn toàn nghiêm ngặt (sCR) | 11 (4,6) | 5 (2,1) |
Đáp ứng hoàn toàn (CR) | 35 (14,6) | 16 (6,8) |
Đáp ứng một phần rất tốt (VGPR) | 96 (40,0) | 47 (20,1) |
Đáp ứng một phần (PR) | 57 (23,8) | 80 (34,2) |
Trung vị thời gian đến khi đạt đáp ứng [tháng (khoảng)] | 0,9 (0,8; 1,4) | 1,6 (1,5; 2,1) |
Trung vị khoảng thời gian đạt đáp ứng [tháng (95% CI)] | NE (11,5; NE) | 7,9 (6,7; 11,3) |
Tỷ lệ MRD âm tính (95% CI) b | 8,8% (5,6%; 13,0%) | 1,2% (0,3%; 3,5%) |
Tỷ suất chênh với 95% CIc | 9,04 (2,53; 32,21) |
|
Giá trị Pd | 0,0001 |
|
DVd = daratumumab- bortezomib-dexamethasone; Vd = bortezomib-dexamethasone;
MRD = tồn lưu tối thiểu bệnh; CI = khoảng tin cậy; NE = không ước lượng được.
a giá trị p từ kiểm định Chi-bình phương Cochran Mantel-Haenszel.
b Dựa trên quần thể Dự định điều trị (Intent-to-treat-ITT) và ngưỡng 10-5.
c Sử dụng ước lượng Mantel-Haenszel với tỷ suất chênh phổ biến. Một tỷ suất chênh OR >1 cho thấy lợi thế của nhóm DVd.
d giá trị p-từ kiểm định chính xác của Fisher.
Trung vị OS là chưa đạt được cho cả hai nhóm điều trị. Với trung vị thời gian theo dõi 7,4 tháng (95% CI: 0,0; 14,9), tỉ số nguy hại đối với OS là 0,77 (95% CI: 0,47; 1,26; p = 0,2975).
Điện sinh lý tim
Daratumumab là một protein lớn ít có khả năng tương tác kênh ion trực tiếp. Tác dụng của daratumumab trên khoảng QTc đã được đánh giá trong một nghiên cứu nhãn mở trên 83 bệnh nhân (nghiên cứu GEN501) bị đa u tủy tái phát và kháng trị sau truyền daratumumab (4 đến 24 mg/kg). Phân tích hỗn hợp tuyến tính PK-PD cho thấy không có sự gia tăng lớn trong khoảng QTcF trung bình (nghĩa là lớn hơn 20 ms) ở nồng độ Cmax của daratumumab.
Dân số bệnh nhân trẻ em
Cơ quan Quản lý Dược phẩm Châu Âu đã miễn nghĩa vụ phải nộp các kết quả nghiên cứu của DARZALEX trên tất cả các phân nhóm trẻ em bị đa u tủy.
– Dược động học (Tác động của cơ thể với thuốc)
Dược động học (PK) của daratumumab sau khi dùng đơn trị liệu daratumumab đường tĩnh mạch đã được đánh giá ở những bệnh nhân đa u tủy tái phát và kháng trị ở liều từ 0,1 mg/kg đến 24 mg/kg.
Trong nhóm dùng từ 1 đến 24 mg/kg, tỷ lệ tăng nồng độ đỉnh trong huyết thanh (Cmax) sau khi dùng liều đầu tiên xấp xỉ tỷ lệ tăng liều dùng và thể tích phân bố phù hợp với sự phân bố ban đầu vào ngăn huyết tương. Sau khi truyền tại tuần cuối, Cmax tăng nhanh hơn so với tỷ lệ theo liều, phù hợp với sự phân bố thuốc qua trung gian đích. Tỷ lệ tăng AUC lớn hơn tỉ lệ tăng liều và độ thanh thải (CL) giảm khi liều tăng. Những quan sát này gợi ý rằng CD38 có thể trở nên bão hòa ở các mức liều cao hơn, và sau đó ảnh hưởng của thanh thải từ liên kết đích là tối thiểu và sự thanh thải daratumumab xấp xỉ thanh thải tuyến tính của IgG1 nội sinh. Thanh thải thuốc cũng giảm khi dùng đa liều, có thể liên quan đến giảm số lượng và kích thước khối u.
Thời gian bán thải cuối tăng lên khi tăng liều và khi dùng đa liều. Thời gian bán thải trung bình (độ lệch chuẩn [SD]) ước tính của daratumumab sau liều 16 mg/kg đầu tiên là 9 (4,3) ngày. Thời gian bán thải ước tính của daratumumab sau liều 16 mg/kg cuối cùng tăng lên, nhưng không có đủ dữ liệu để ước tính một cách tin cậy. Dựa trên phân tích PK quần thể, thời gian bán thải trung bình (SD) liên quan đến thải trừ tuyến tính không đặc hiệu là khoảng 18 (9) ngày; đây là thời gian bán thải cuối cùng mà có thể được mong đợi khi đã bão hòa hoàn toàn thanh thải qua trung gian đích và chế độ đa liều của daratumumab.
Ở cuối giai đoạn dùng liều hàng tuần theo chế độ liều đơn trị liệu được khuyến cáo và liều 16 mg/kg, giá trị Cmax trong huyết thanh trung bình (SD) là 915 (410,3) mcg/mL, cao hơn khoảng 2,9 lần so với lần truyền đầu tiên. Nồng độ huyết thanh trước khi truyền (đáy) trung bình (SD) vào cuối chế độ liều dùng hàng tuần là 573 (331,5) mcg/mL.
Đã tiến hành bốn phân tích PK quần thể để mô tả đặc tính PK của daratumumab và để đánh giá ảnh hưởng của sự biến thiên về phân bố của daratumumab ở bệnh nhân đa u tủy; Phân tích 1 (n=223) ở bệnh nhân dùng DARZALEX đơn trị liệu trong khi Phân tích 2 (n=694), Phân tích 3 (n=352) và Phân tích 4 (n=355) được tiến hành ở bệnh nhân đa u tủy trong trị liệu kết hợp của daratumumab. Phân tích 2 bao gồm 694 bệnh nhân (n=326 cho lenalidomide-dexamethasone; n=246 cho bortezomib-dexamethasone; n=99 cho pomalidomide-dexamethasone; n=11 cho bortezomib-melphalan-prednisone; và n=12 cho bortezomib-thalidomide-dexamethasone), Phân tích 3 bao gồm 352 bệnh nhân (bortezomib‑melphalan‑prednisone) và Phân tích 4 gồm 355 bệnh nhân (lenalidomide-dexamethasone).
Dựa trên phân tích PK quần thể đối với đơn trị liệu daratumumab (Phân tích 1), trạng thái ổn định của daratumumab đạt được sau khoảng 5 tháng vào mỗi giai đoạn đưa liều mỗi 4 tuần (đến liều truyền thứ 21) và tỷ số trung bình (SD) của Cmax ở trạng thái ổn định trên Cmax sau lần đưa liều đầu tiên là 1,6 (0,5). Thể tích phân bố ở ngăn trung tâm trung bình (SD) là 56,98 (18,07) mL/kg.
Ba phân tích PK quần thể bổ sung (Phân tích 2, Phân tích 3 và Phân tích 4) đã được thực hiện ở những bệnh nhân đa u tủy có dùng phác đồ kết hợp có daratumumab trong trị liệu kết hợp. Dữ liệu nồng độ – thời gian của daratumumab tương tự nhau sau liệu pháp đơn trị liệu và điều trị phối hợp. Thời gian bán thải cuối cùng ước tính trung bình liên quan đến thanh thải tuyến tính trong trị liệu kết hợp là khoảng 15-23 ngày.
Dựa trên bốn phân tích PK quần thể (Phân tích 1-4), đã xác định trọng lượng cơ thể là một yếu tố có ý nghĩa thống kê đối với thanh thải daratumumab. Do đó, việc sử dụng liều theo trọng lượng cơ thể là một chiến lược đưa liều phù hợp cho bệnh nhân đa u tủy.
Sự mô phỏng dược động học của daratumumab được thực hiện cho tất cả các chế độ liều trên 1.309 bệnh nhân đa u tủy. Kết quả mô phỏng này khẳng định rằng việc chia liều và dùng liều duy nhất cho liều đầu tiên có PK tương đương, ngoại trừ dữ liệu PK vào ngày điều trị đầu tiên.
Các quần thể dân số đặc biệt
Tuổi và giới tính
- Dựa trên bốn phân tích PK quần thể riêng lẻ (1-4) ở bệnh nhân dùng daratumumab đơn trị liệu hay trị liệu phối hợp (Phân tích 1-4), tuổi (khoảng: 31 đến 93 tuổi) không có ảnh hưởng quan trọng về lâm sàng trên PK của daratumumab, và nồng độ daratumumab tương tự nhau giữa các bệnh nhân trẻ hơn (< 65 tuổi, n = 518) và các bệnh nhân cao tuổi hơn (tuổi ≥ 65 đến < 75 tuổi, n = 761; tuổi ≥ 75, n = 334).
- Giới tính không ảnh hưởng đến nồng độ của daratumumab với mức độ có ý nghĩa lâm sàng trong các phân tích PK quần thể.
Suy thận
Không thực hiện nghiên cứu chính thức về daratumumab ở bệnh nhân suy thận. Bốn phân tích PK quần thể riêng lẻ được thực hiện dựa trên dữ liệu chức năng thận đã có ở bệnh nhân dùng đơn trị liệu daratumumab hoặc trị liệu kết hợp (Phân tích 1-4), và bao gồm tổng số 441 bệnh nhân có chức năng thận bình thường (độ thanh thải creatinine [CRCL] ≥ 90 mL/phút), 621 bệnh nhân suy thận nhẹ (CRCL < 90 và ≥ 60 mL/phút), 523 bệnh nhân suy thận trung bình (CRCL < 60 và ≥ 30 mL/phút) và 27 bệnh nhân suy thận nặng hoặc có bệnh thận giai đoạn cuối (CRCL < 30 mL/phút). Không có sự khác biệt quan trọng trên lâm sàng về nồng độ daratumumab giữa những bệnh nhân suy thận và những người có chức năng thận bình thường.
Suy gan
- Không tiến hành nghiên cứu chính thức về daratumumab ở những bệnh nhân bị suy gan. Sự thay đổi chức năng gan dường như không có bất kỳ tác dụng nào trên sự thải trừ của daratumumab do các phân tử IgG1 như daratumumab không được chuyển hóa qua các con đường chuyển hóa ở gan.
- Bốn phân tích PK quần thể riêng biệt được thực hiện trên bệnh nhân dùng daratumumab đơn trị liệu hoặc trị liệu kết hợp khác nhau (Phân tích 1-4), bao gồm tổng số 1404 bệnh nhân có chức năng gan bình thường (bilirubin toàn phần [TB] và aspartate aminotransferase [AST] ≤ giới hạn trên bình thường [ULN], 189 bệnh nhân suy gan nhẹ (TB 1,0 x đến 1,5 x ULN hoặc AST> ULN) và 8 bệnh nhân có suy giảm chức năng gan mức độ trung bình (TB > 1,5 x đến 3,0 x ULN; n=7), hoặc nặng (TB > 3,0 x ULN; n=1). Không có sự khác biệt quan trọng về mặt lâm sàng về mức độ phơi nhiễm daratumumab giữa những bệnh nhân bị suy gan và những người có chức năng gan bình thường.
Chủng tộc
Dựa trên bốn phân tích PK quần thể riêng biệt ở bệnh nhân dùng daratumumab đơn trị liệu hoặc trị liệu kết hợp khác nhau (Phân tích 1-4), nồng độ daratumumab tương tự nhau giữa các đối tượng da trắng (n = 1371) và không phải da trắng (n = 242).
Dữ liệu an toàn tiền lâm sàng
Dữ liệu về độc tính thu được từ các nghiên cứu của daratumumab trên tinh tinh và với một kháng thể kháng CD38 đại diện ở khỉ cynomolgus. Không tiến hành thử nghiệm độc tính mạn tính.
Tính sinh ung thư và gây đột biến
Không thực hiện nghiên cứu trên động vật để xác định khả năng gây ung thư của daratumumab.
Độc tính trên hệ sinh sản
Không thực hiện nghiên cứu trên động vật để đánh giá tác động tiềm tàng của daratumumab đối với sự sinh sản hoặc phát triển.
Khả năng sinh sản
Không thực hiện nghiên cứu trên động vật để xác định tác động tiềm tàng đối với khả năng sinh sản của nam giới hoặc phụ nữ.
8. Thông tin thêm
– Đặc điểm
Dạng bào chế: Dung dịch đậm đặc để pha dung dịch truyền.
Mô tả: Dung dịch từ không màu đến màu vàng.
– Thông tin khác
Các tá dược có tác dụng: Mỗi lọ DARZALEX 5 mL và 20 mL có chứa tương ứng 0,4 mmol và 1,6 mmol (tương ứng với 9,3 mg và 37,3 mg) natri.
Thận trọng đặc biệt về hủy thuốc và xử lý khác
Sản phẩm này chỉ để dùng một lần.
Chuẩn bị dung dịch truyền bằng kỹ thuật vô khuẩn như sau:
- Tính liều (mg), tổng thể tích (mL) của dung dịch DARZALEX cần thiết và số lọ DARZALEX cần thiết dựa trên trọng lượng bệnh nhân.
- Kiểm tra dung dịch DARZALEX từ không màu đến vàng. Không sử dụng nếu có các tiểu phân gây đục, bị biến màu hoặc có các tiểu phân lạ khác.
- Sử dụng kỹ thuật vô khuẩn, lấy ra một thể tích Natri Chloride 0,9% từ túi truyền/chai truyền tương đương với thể tích DARZALEX cần dùng.
- Rút ra lượng dung dịch DARZALEX cần thiết và pha loãng với thể tích thích hợp bằng cách thêm vào một túi/chai truyền có chứa Natri Chloride 0,9%. Túi/chai truyền thuốc phải được làm bằng polyvinylchloride (PVC), polypropylene (PP), polyethylene (PE) hoặc hỗn hợp polyolefin (PP + PE). Pha loãng trong điều kiện vô khuẩn phù hợp. Hủy bỏ bất kỳ phần không sử dụng còn lại trong lọ.
- Nhẹ nhàng lộn ngược túi/chai để trộn dung dịch. Không lắc.
- Kiểm tra bằng mắt đối với các sản phẩm thuốc tiêm về các tiểu phân và sự biến màu trước khi dùng. Dung dịch đã pha loãng có thể xuất hiện các tiểu phân protein rất nhỏ, mờ đến trắng, do daratumumab là một protein. Không sử dụng nếu nhìn thấy các tiểu phân đục rõ, đổi màu hoặc các tiểu phân lạ.
- Do DARZALEX không chứa chất bảo quản, dung dịch đã pha loãng cần được sử dụng trong vòng 15 giờ (kể cả thời gian truyền) ở nhiệt độ phòng (15°C – 25°C) và trong ánh sáng phòng.
- Nếu không sử dụng ngay, dung dịch đã pha loãng có thể được bảo quản trước khi dùng cho đến 24 giờ trong điều kiện làm lạnh (2°C – 8°C) và tránh ánh sáng. Không để đông lạnh.
- Dùng dung dịch đã pha loãng bằng cách truyền tĩnh mạch, sử dụng bộ truyền có gắn bộ điều chỉnh dòng chảy và có bộ lọc polyetersulfone (PES) liên kết với protein thấp, không gây sốt, vô trùng (kích thước lỗ 0,22 hoặc 0,2 mcm). Phải sử dụng bộ dây chuyền làm bằng polyurethane (PU), polybutadiene (PBD), PVC, PP hoặc PE.
- Không truyền DARZALEX đồng thời vào cùng đường tĩnh mạch với các thuốc khác.
- Không cất giữ phần dung dịch truyền không sử dụng để sử dụng lại. Bất kỳ sản phẩm không sử dụng hoặc chất thải nào cũng phải được xử lý theo yêu cầu của địa phương.
– Bảo quản
Bảo quản lọ thuốc trong hộp carton để tránh ánh sáng.
Bảo quản lọ thuốc chưa mở nắp ở 2°C – 8°C. Không để đông đá. Không lắc lọ thuốc.
– Quy cách đóng gói
Thuốc được đóng trong lọ thủy tinh loại 1 với nút cao su đàn hồi bọc nhôm và nắp “flip-off”.
Hộp 1 lọ 20 mL chứa 400 mg Daratumumab..
– Hạn dùng
Lọ chưa mở nắp: 24 tháng kể từ ngày sản xuất.
Sau khi pha loãng: Trên quan điểm vi sinh học, trừ khi phương pháp mở nắp/pha loãng phòng ngừa được nguy cơ lây nhiễm vi sinh, nên sử dụng sản phẩm ngay lập tức. Nếu không sử dụng ngay, người sử dụng chịu trách nhiệm về thời gian và điều kiện bảo quản và không để quá 24 giờ trong điều kiện được làm lạnh (2°C – 8°C), tránh ánh sáng, tiếp theo là 15 giờ (bao gồm thời gian truyền) ở nhiệt độ phòng (15°C – 25°C) và ánh sáng trong phòng.
– Nhà sản xuất
Cilag AG.










Đánh giá
Chưa có đánh giá nào.