| Mọi thông tin dưới đây đã được Dược sĩ biên soạn lại. Tuy nhiên, nội dung hoàn toàn giữ nguyên dựa trên tờ Hướng dẫn sử dụng, chỉ thay đổi về mặt hình thức. |
1. Thành phần
Afatinib (dạng bazơ tự do) 30 mg tương ứng với Afatinib dimaleat 44,34 mg.
2. Công dụng (Chỉ định)
- GIOTRIF đơn trị liệu được chỉ định điều trị ung thư phổi không tế bào nhỏ tiến xa tại chỗ hoặc di căn có đột biến thụ thể yếu tố tăng trưởng biểu bì (EGFR) cho bệnh nhân trưởng thành chưa được điều trị trước đó bằng thuốc ức chế EGFR Tyrosine Kinase.
- GIOTRIF được chỉ định để điều trị cho bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC), thuộc loại ung thư phổi tế bào vảy, tiến triển tại chỗ hoặc di căn, đang hoặc đã được hóa trị liệu bằng các dẫn chất của platin.
3. Cách dùng – Liều dùng
- Giotrif phải được khởi đầu điều trị và giám sát bởi bác sỹ có kinh nghiệm trong sử dụng thuốc điều trị ung thư.
- Tình trạng đột biến EGFR phải được xác định trước khi khởi đầu điều trị bằng Giotrif.
- Liều GIOTRIF khuyến cáo là 40 mg uống một lần mỗi ngày đối với điều trị bước một hoặc đối với những bệnh nhân chưa được điều trị trước đó bằng thuốc ức chế EGFR Tyrosine Kinase (bệnh nhân chưa bao giờ dùng EGFR TKI).
- Liều khuyến cáo cho bệnh nhân NSCLC tế bào vảy đã từng được điều trị bước một bằng phác đồ có chứa các dẫn chất của platin trước đó là 40 mg x 1 lần/ngày, dùng đường uống.
- Không nên uống GIOTRIF cùng với thức ăn. Không nên ăn ít nhất 3 giờ trước hoặc ít nhất 1 giờ sau khi uống GIOTRIF. Nên nuốt trọn viên thuốc với nước.
- Nên điều trị bằng GIOTRIF liên tục cho đến khi bệnh tiến triển hoặc bệnh nhân không còn dung nạp được thuốc (xem bảng 5).
Tăng liều
- Có thể cân nhắc tăng đến liều tối đa là 50 mg mỗi ngày ở những bệnh nhân dung nạp được liều khởi đầu 40 mg mỗi ngày (tức là không bị tiêu chảy, nổi ban, viêm miệng và các biến cố khác liên quan đến thuốc với mức độ > 1 theo CTCAE) trong chù kỳ điều trị đầu tiên (xem định nghĩa chu kỳ điều trị trong phần Dược lý). Không nên tăng liều ở những bệnh nhân đã giảm liều trước đó.
- Trong bất kỳ trường hợp nào, liều tối đa mỗi ngày là 50 mg.
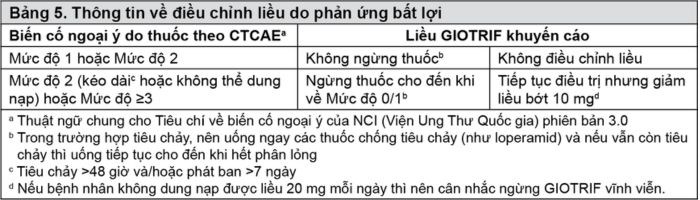
Điều chỉnh liều do phản ứng bất lợi
Phản ứng bất lợi gây triệu chứng liên quan đến thuốc (như tiêu chảy nặng/kéo dài hoặc phản ứng ngoại ý biểu hiện trên da) có thể được xử trí tốt bằng cách tạm ngừng điều trị và giảm liều GIOTRIF như nêu trong Bảng 6 (xem “Tác dụng không mong muốn”, để biết thêm chi tiết về cách xử trí các biến cố ngoại ý đặc hiệu do thuốc xem “Cảnh báo và thận trọng”).
Nên nghĩ đến bệnh phổi mô kẽ (ILD) nếu một bệnh nhân có các triệu chứng hô hấp cấp tính hoặc xấu đi, trường hợp này nên tạm ngừng GIOTRIF trong khi chờ đánh giá. Nếu được chẩn đoán ILD thì nên ngừng GIOTRIF và tiến hành điều trị thích hợp.
Quá liều
Triệu chứng
Trong các nghiên cứu lâm sàng Pha I, liều GIOTRIF cao nhất được nghiên cứu trên số lượng giới hạn bệnh nhân là 160 mg một lần mỗi ngày trong 3 ngày và 100 mg một lần mỗi ngày trong 2 tuần. Các phản ứng bất lợi quan sát thấy khi dùng những liều này chủ yếu là biến cố trên da (phát ban/mụn trứng cá) và trên đường tiêu hóa (đặc biệt là tiêu chảy). Quá liều ở 2 thanh niên khỏe mạnh khi mỗi người uống 360 mg GIOTRIF (là một phần của hỗn hợp thuốc uống vào) gây ra các phản ứng bất lợi liên quan đến thuốc: buồn nôn, nôn, suy nhược, chóng mặt, đau đầu, đau bụng và tăng amylase (<1,5 lần giới hạn trên của mức bình thường). Hai người đều hồi phục khỏi các biến cố ngoại ý.
Điều trị
- Không có thuốc giải đặc hiệu khi quá liều GIOTRIF. Trong trường hợp nghi quá liều thì nên ngừng dùng GIOTRIF và điều trị nâng đỡ.
- Nếu có chỉ định thì có thể loại bỏ afatinib chưa hấp thu bằng cách gây nôn hoặc rửa dạ dày.
Quên liều
Nếu quên một liều GIOTRIF thì nên uống trong ngày ngay khi nhớ ra. Tuy nhiên, bỏ qua liều bị quên nếu liều kế tiếp theo lịch trình sẽ uống trong vòng 8 giờ.
4. Chống chỉ định
Chống chỉ định dùng GIOTRIF cho những bệnh nhân quá mẫn với Afatinib hoặc với bất kỳ tá dược nào.
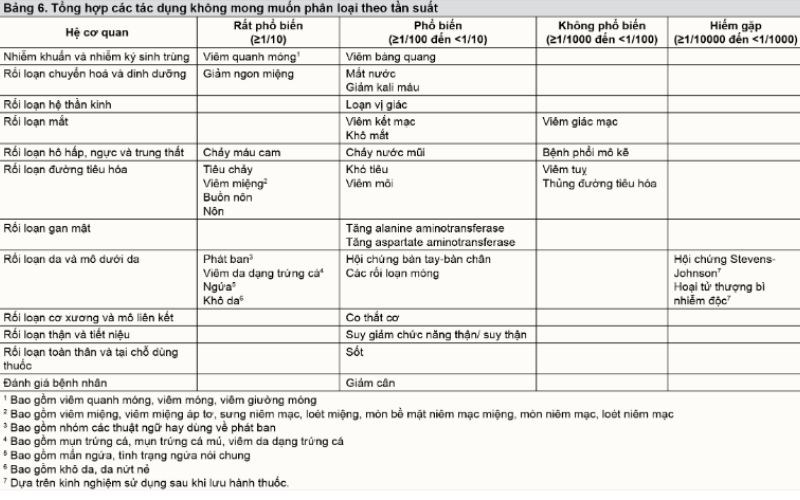
5. Tác dụng phụ
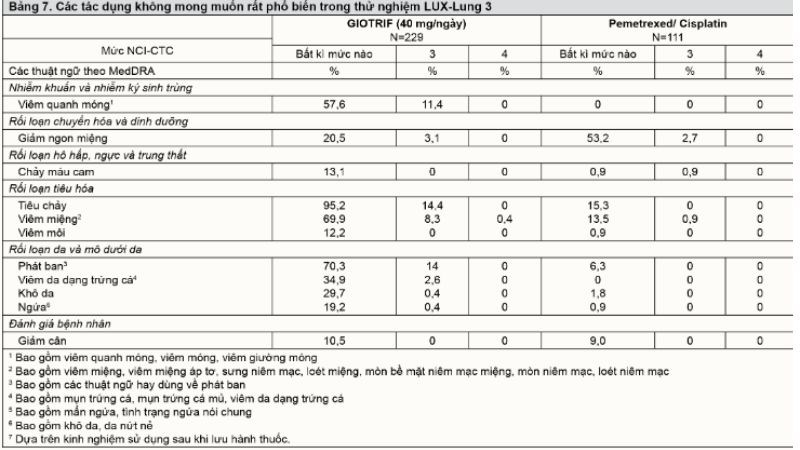
- Các loại tác dụng không mong muốn (ADR) nói chung liên quan đến phương thức ức chế EGFR trong hoạt động của afanitib. Tất cả các tác dụng không mong muốn được tổng hợp trong Bảng 6. Tác dụng không mong muốn hay gặp nhất là tiêu chảy và các biến cố ngoại ý trên da và viêm miệng, viêm quanh móng (xem thêm Bảng 7).
- Nói chung, giảm liều dẫn đến giảm tần suất của các phản ứng phụ hay gặp. Ở bệnh nhân điều trị với Giotrif 40 mg một lần một ngày, giảm liều do các tác dụng không mong muốn xảy ra ở 57% bệnh nhân trong thử nghiệm lâm sàng LUX-Lung 3. Dừng thuốc do các tác dụng không mong muốn tiêu chảy và phát ban/nổi mụn là 1,3% và 0% trong thử nghiệm LUX-Lung 3.
- Phản ứng giống như bệnh phổi mô kẽ được báo cáo ở 0,7% bệnh nhân điều trị với afatinib. Đã có báo cáo trường hợp da bóng nước, phồng rộp, tróc vảy, kể cả trường hợp hiếm gợi ý hội chứng Stevens-Johnson và hoại tử thượng bì nhiễm độc mặc dù những trường hợp này có thể do nguyên nhân khác.
Những bất thường trong xét nghiệm chức năng gan
- Những bất thường trong xét nghiệm chức năng gan (bao gồm tăng ALT và AST) được quan sát thấy ở những bệnh nhân dùng Giotrif 40 mg. Sự tăng lên này phần lớn là thoáng qua và không dẫn tới việc phải dừng thuốc. Tăng ALT mức 2 (>2,5 đến 5,0 lần giới hạn trên bình thường) xảy ra ở dưới 8% bệnh nhân điều trị với thuốc này. Tăng ALT mức 3 (>5,0 đến 20,0 lần giới hạn trên bình thường) xảy ra ở dưới 4% bệnh nhân điều trị với Giotrif (xem mục ”Cảnh báo và thận trọng”).
- Trong thử nghiệm LUX-Lung 6 (1200.34), tổng số 239 bệnh nhân chưa điều trị bằng EGFR TKI được điều trị với Giotrif với liều khởi đầu 40 mg một lần mỗi ngày. Tổng số 113 bệnh nhân được điều trị với gemcitabine/cisplatin. Tỷ lệ tác dụng không mong muốn nói chung ở bệnh nhân điều trị với Giotrif tương tự như với gemcitabine/cisplatin (98,7% so với 99,1%). Tỷ lệ biến cố tiêu chảy (88, 7% so với 10,6%) và phát ban/mụn trứng cá (81,2% so với 8,8%) cao hơn ở bệnh nhân dùng Giotrif so với bệnh nhân dùng gemcitabine/cisplatin. Giảm liều do các tác dụng không mong muốn xảy ra ở 33,1% bệnh nhân điều trị với Giotrif và ở 26,5% bệnh nhân điều trị với gemcitabine/cisplatin. Dừng thuốc nghiên cứu do tác dụng không mong muốn ở bệnh nhân điều trị với Giotrif xảy ra ít hơn so với gemcitabine/cisplatin (6,3% so với 39,8%). Ở bệnh nhân điều trị với Giotrif, tỷ lệ dừng thuốc do biến cố tiêu chảy và phát ban/mụn trứng cá lần lượt là 0% và 2,5%.
- Trong thử nghiệm then chốt LUX-lung 8 (1200.125), tất cả 392 bệnh nhân có NSCLC tế bào vảy được điều trị bằng GIOTRIF với liều khởi đầu 40 mg x 1 lần/ngày và 395 bệnh nhân được điều trị bằng erlotinib 150 mg x 1 lần/ngày. Sau chu kỳ điều trị đầu tiên (28 ngày), liều của GIOTRIF được tăng lên 50 mg ở 39 (10%) bệnh nhân. Tỷ lệ ghi nhận ADR ở bệnh nhân được điều trị bằng GIOTRIF và erlotinib lần lượt tương ứng là 93% và 81%. Tỷ lệ ghi nhận biến cố tiêu chảy ở nhóm bệnh nhân dùng GIOTRIF cao hơn so với erlotinib (70% và 33%), trong khi tỷ lệ ghi nhận nổi ban mẩn/mụn trên da tương tự ở cả hai nhóm (67% và 67%). 27% số bệnh nhân ở nhóm điều trị bằng GIOTRIF được giảm liều thuốc do tác dụng không mong muốn. 11% số bệnh nhân ở nhóm GIOTRIF và 5% ở nhóm erlotinib phải ngừng thuốc do ADR.
- Tính an toàn của GIOTRIF đơn trị liệu trên bệnh nhân ung thư biểu mô tế bào vảy sử dụng liều khởi đầu 40 mg được đánh giá trong thử nghiệm LUX-Lung 8. ADR thường gặp nhất có liên quan đến tác dụng ức chế EGFR của GIOTRIF và tương tự với kết quả của thử nghiệm LUX-Lung 3 và LUX-Lung 1 tiến hành trên bệnh nhân ung thư biểu mô tuyến ở phổi. Phần lớn bệnh nhân gặp ADR (65%) ở mức độ 1 và 2. ADR tiêu chảy mức độ 3/4 theo thang CTCAE được ghi nhận trên 9,9% / 0,5% bệnh nhân. Tỷ lệ ghi nhận ADR nổi ban mẩn do thuốc mức độ 3 theo thang CTCAE là 5,9%. ADR gây ra ngừng thuốc ở 11% bệnh nhân.
Dừng điều trị do tác dụng không mong muốn tiêu chảy và phát ban/mụn trứng cá không kể mức độ nghiêm trọng xảy ra ở 3,8% và 2,0% bệnh nhân.
6. Lưu ý |
– Thận trọng khi sử dụngĐánh giá tình trạng đột biến EGFR Khi đánh giá tình trạng đột biến EGFR ở một bệnh nhân, điều quan trọng là lựa chọn một phương pháp chính xác và đã được thẩm định kỹ để tránh kết quả âm tính giả hoặc dương tính giả. Tiêu chảy
Biến cố ngoại ý trên da
Bệnh nhân nữ, nhẹ cân và có sẵn suy thận Đã quan sát thấy nồng độ theo thời gian của afatinib cao ở những bệnh nhân nữ, nhẹ cân và những bệnh nhân có sẵn suy thận. Điều này có thể làm tăng nguy cơ xuất hiện các biến cố ngoại ý qua trung gian EGFR như tiêu chảy, phát ban/mụn trứng cá và viêm miệng. Nên theo dõi chặt chẽ bệnh nhân có những yếu tố nguy cơ này. Bệnh phổi mô kẽ (ILD) Đã có báo cáo ILD hoặc biến cố giống ILD (như thâm nhiễm phổi, viêm phổi, hội chứng suy hô hấp cấp, viêm phế nang dị ứng), kể cả tử vong ở những bệnh nhân dùng GIOTRIF để điều trị NSCLC. Các biến cố giống ILD liên quan đến thuốc được báo cáo ở 0,7% trong số bệnh nhân được điều trị với Giotrif trong tất cả các nghiên cứu (bao gồm 0,5% bệnh nhân có biến cố giống ILD mức độ ≥3 theo CTCAE. Chưa nghiên cứu ở những bệnh nhân có tiền sử ILD. Nên đánh giá cẩn thận tất cả những bệnh nhân có các triệu chứng ở phổi (khó thở, ho, sốt) biểu hiện cấp tính và/hoặc tiến triển xấu không rõ nguyên nhân để loại trừ ILD. Nên tạm ngừng điều trị GIOTRIF trong khi chờ đánh giá các triệu chứng. Nên ngừng điều trị vĩnh viễn bằng GIOTRIF nếu chẩn đoán là ILD và điều trị thích hợp khi cần. Suy gan nặng Suy gan, kể cả tử vong, đã được báo cáo trong thời gian điều trị bằng GIOTRIF với tỷ lệ dưới 1% bệnh nhân. Ở những bệnh nhân này, các yếu tố gây nhiễu bao gồm bệnh gan đã có từ trước và/hoặc các bệnh đi kèm cùng với sự tiến triển của khối u ác tính. Nên kiểm tra chức năng gan định kỳ cho những bệnh nhân đã bị bệnh gan từ trước. Có thể cần tạm ngừng GIOTRIF ở những bệnh nhân có chức năng gan xấu đi. Nên ngừng vĩnh viễn điều trị bằng GIOTRIF nếu bệnh nhân xuất hiện suy gan nghiêm trọng trong thời gian dùng thuốc. Thủng đường tiêu hóa Thủng đường tiêu hóa, bao gồm tử vong, đã được báo cáo khi điều trị với Giotrif ở 0,2% bệnh nhân trong tất cả thử nghiệm lâm sàng có đối chứng ngẫu nhiên. Trong phần lớn các trường hợp, thủng đường tiêu hóa có liên quan đến các yếu tố nguy cơ khác đã được biết, bao gồm các thuốc dùng đồng thời như các thuốc corticosteroid, NSAID, hoặc các thuốc chống tăng sinh mạch máu, tiền sử có loét đường tiêu hóa, bệnh túi thừa sẵn có, tuổi tác, hoặc di căn ở ruột tại vị trí thủng. Ở bệnh nhân xuất hiện thủng đường tiêu hóa khi dùng Giotrif, cần dừng điều trị vĩnh viễn. Viêm giác mạc Cần đi khám chuyên khoa mắt ngay nếu có các triệu chứng viêm mắt cấp tính hoặc tiến triển xấu, chảy nước mắt, nhạy cảm ánh sáng, nhìn mờ, đau mắt và/hoặc đỏ mắt. Nếu được chẩn đoán viêm loét giác mạc thì nên tạm ngừng hoặc ngừng vĩnh viễn điều trị bằng GIOTRIF. Nếu chẩn đoán viêm giác mạc thì nên cân nhắc thận trọng giữa lợi ích và nguy cơ của việc tiếp tục điều trị. Nên thận trọng khi dùng GIOTRIF cho những bệnh nhân có tiền sử viêm giác mạc, viêm loét giác mạc hoặc khô mắt nặng. Sử dụng kính áp tròng cũng là yếu tố nguy cơ của viêm giác mạc và loét (xem “Tác dụng không mong muốn”). Chức năng thất trái Rối loạn chức năng thất trái có liên quan đến sự ức chế HER2. Dựa trên dữ liệu lâm sàng đã có, không có gợi ý cho thấy GIOTRIF gây tác dụng bất lợi trên sự co bóp tim. Tuy nhiên, chưa có nghiên cứu của GIOTRIF ở những bệnh nhân có phân suất tống máu thất trái (LVEF) bất thường hoặc có tiền sử bệnh tim nặng. Ở những bệnh nhân có các yếu tố nguy cơ về tim và những bệnh nhân bị bệnh có thể ảnh hưởng đến LVEF, nên cân nhắc theo dõi tim mạch, bao gồm đánh giá LVEF tại thời điểm bắt đầu và trong thời gian điều trị GIOTRIF. Nếu bệnh nhân xuất hiện các dấu hiệu/triệu chứng liên quan đến tim trong thời gian điều trị thì nên theo dõi tim mạch bao gồm đánh giá LVEF. Ở những bệnh nhân có phân suất tống máu thấp hơn giới hạn dưới của mức bình thường theo quy định thì nên khám chuyên khoa tim mạch cũng như cân nhắc tạm ngừng hoặc ngừng vĩnh viễn điều trị bằng GIOTRIF. – Thai kỳ và cho con búThai kỳ Những nghiên cứu phi lâm sàng với afatinib cho thấy không có dấu hiệu quái thai khi dùng đến liều gây tử vong con mẹ. Những thay đổi bất lợi chỉ xuất hiện ở liều gây độc rõ ràng (xem “Độc tính”). Chưa có nghiên cứu ở phụ nữ mang thai dùng GIOTRIF. Vì thế nguy cơ tiềm tàng trên người chưa rõ. Phụ nữ có khả năng sinh đẻ nên được khuyên tránh có thai trong thời gian điều trị bằng GIOTRIF. Nên sử dụng các biện pháp tránh thai thích hợp trong thời gian dùng thuốc và ít nhất 2 tuần sau khi dùng liều thuốc cuối cùng. Nếu GIOTRIF được sử dụng trong thời kỳ mang thai hoặc nếu bệnh nhân mang thai trong thời gian dùng GIOTRIF thì nên thông báo cho bệnh nhân những nguy hiểm tiềm tàng cho thai. Cho con bú Dựa trên dữ liệu phi lâm sàng, có khả năng afatinib được bài xuất vào sữa mẹ. Không thể loại trừ nguy cơ cho trẻ bú mẹ. Nên khuyên người mẹ không cho con bú khi đang dùng GIOTRIF. Khả năng sinh sản Không có nghiên cứu của GIOTRIF về khả năng sinh sản ở người. Dữ liệu độc tính phi lâm sàng thu được đã chứng minh ảnh hưởng đến cơ quan sinh sản khi dùng liều cao. Do đó không thể loại trừ tác dụng ngoại ý trên khả năng sinh sản ở người khi điều trị bằng GIOTRIF. – Khả năng lái xe và vận hành máy mócKhông có nghiên cứu về ảnh hưởng đến khả năng lái xe và vận hành máy móc. – Tương tác thuốcTương tác với thuốc ức chế P-glycoprotein (P-gp)
Ảnh hưởng của thức ăn đến afatinib Uống GIOTRIF cùng với bữa ăn giàu chất béo làm giảm đáng kể nồng độ theo thời gian của afatinib, cụ thể Cmax giảm khoảng 50% và AUC0-∞ giảm khoảng 39%. Do đó không nên dùng GIOTRIF cùng với thức ăn. |
7. Dược lý
– Dược lực học (Tác động của thuốc lên cơ thể)
Nhóm điều trị dược lý: các thuốc chống ung thư khác – ức chế protein kinase, mã ATC: L01XE13.
Cơ chế tác dụng
Afatinib là một chất ức chế nhóm ErbB có tác dụng mạnh, chọn lọc và không hồi phục. Afatinib liên kết cộng hóa trị và ức chế không hồi phục các tín hiệu từ homo- và heterodimer hình thành bởi các thành viên thuộc nhóm ErbB: EGFR (ErbB1), HER2 (ErbB2), ErbB3 và ErbB4.
Tác dụng dược lực học
- Tín hiệu ErbB sai lệch có thể được kích hoạt bởi đột biến và/hoặc khuếch đại của EGFR, khuếch đại hoặc đột biến HER2 và/hoặc tăng biểu hiện thụ thể hoặc ligand ErbB góp phần tạo đặc tính bất thường trong các phân nhóm bệnh nhân bị nhiều loại ung thư khác nhau.
- Trong những mô hình bệnh lý tiền lâm sàng có mất kiểm soát lộ trình ErbB, afatinib dùng đơn chất có tác dụng ức chế hiệu quả dẫn truyền tín hiệu của thụ thể ErbB gây ức chế tăng trưởng khối u hoặc thoái triển khối u. Mô hình NSCLC với sự đột biến L858R hoặc Del 19 EGFR đặc biệt nhạy cảm khi điều trị với afatinib. Đột biến T790M thứ phát là cơ chế chính của hiện tượng kháng thuốc afatinib mắc phải và lượng allele có chứa T790M tỷ lệ với mức độ kháng thuốc trên in vitro. Đột biến T790M được tìm thấy ở khoảng 50% khối u của bệnh nhân được điều trị bằng afatinib. Đối với những bệnh nhân này, thuốc ức chế EGFR Tyrosin kinase hướng đích T790M có thể được cân nhắc là lựa chọn điều trị tiếp theo.
– Dược động học (Tác động của cơ thể với thuốc)
Hấp thu và phân phối
- Sau khi uống GIOTRIF, nồng độ tối đa (Cmax) của afatinib được quan sát thấy khoảng 2 đến 5 giờ sau khi dùng thuốc. Giá trị Cmax và AUC0-∞ trung bình tăng nhẹ hơn mức tỷ lệ trong khoảng liều GIOTRIF từ 20 mg đến 50 mg. Nồng độ theo thời gian toàn thân của afatinib giảm 50% (Cmax) và 39% (AUC0-∞), khi uống cùng với thức ăn giàu chất béo so với khi uống lúc đói. Dựa trên dữ liệu dược động học quần thể thu được từ các thử nghiệm lâm sàng với các loại khối u khác nhau, đã thấy AUCτ,s giảm trung bình 26% khi ăn trong vòng 3 giờ trước hoặc 1 giờ sau khi dùng GIOTRIF. Do đó, không nên ăn trong vòng ít nhất 3 giờ trước và trong vòng ít nhất 1 giờ sau khi uống GIOTRIF (xem “Liều lượng và Cách dùng” và “Tương tác”). Sau khi dùng GIOTRIF, sinh khả dụng tương đối trung bình là 92% (tỷ số trung bình nhân hiệu chỉnh của AUC0-∞) khi so sánh với dạng dung dịch uống.
- In vitro afatinib gắn kết với protein trong huyết tương người khoảng 95%.
Chuyển hóa và thải trừ
Các phản ứng chuyển hóa bởi enzyme xúc tác đóng vai trò không đáng kể đối với afatinib in vivo. Sản phẩm gắn kết cộng hóa trị với protein là các chất chuyển hóa chính của afatinib.
Sau khi uống 15 mg afatinib dạng dung dịch, 85,4% liều dùng được tìm thấy trong phân và 4,3% trong nước tiểu. Hợp chất afatinib ban đầu chiếm 88% liều dùng được phát hiện. Thời gian bán thải cuối biểu kiến là 37 giờ. Nồng độ trong huyết tương ở trạng thái ổn định của afatinib đạt được trong vòng 8 ngày sau khi dùng nhiều liều afatinib gây tích lũy AUC gấp 2,77 lần và Cmax gấp 2,11 lần.
8. Thông tin thêm
– Đặc điểm
Viên nén bao phim cạnh vát, hai mặt lồi, hình tròn, màu xanh dương đậm, dập chìm biểu tượng công ty Boehringer Ingelheim trên một mặt và chữ “T30” trên mặt còn lại.
– Bảo quản
Bảo quản nơi khô ráo, thoáng mát, nhiệt độ <30°C.
– Quy cách đóng gói
Hộp 4 vỉ x 7 viên.
– Hạn dùng
36 tháng kể từ ngày sản xuất.
– Nhà sản xuất
Boehringer Ingelheim.




Đánh giá
Chưa có đánh giá nào.