| Toàn bộ thông tin dưới đây được Dược sĩ biên soạn lại dựa trên tờ Hướng dẫn sử dụng. Thông tin không thay đổi chỉ định dạng lại cho dễ đọc. |
1. Thành phần
Mỗi bơm tiêm đóng sẵn thuốc 0,6 ml chứa:
- Thành phần hoạt chất: Pegfilgrastim* 6,0 mg.
- Thành phần tá dược: D-sorbitol, polysorbate 20, sodium, acetate, nước pha tiêm.
*Sản xuất bởi tế bào của Escherichia coli bằng kỹ thuật tái tổ hợp DNA tiếp theo là kết nối với polyethylene glycol (PEG).
Hoạt lực của sản phẩm này không thể so sánh với hoạt lực của sản phẩm protein kết nối hoặc không kết nối với PEG của cùng một nhóm trị liệu.
2. Công dụng (Chỉ định)
Làm giảm thời gian suy giảm bạch cầu trung tính và tỷ lệ bị sốt do giảm bạch cầu trung tính ở các bệnh nhân được chữa trị bằng hóa trị liệu độc tế bào trong điều trị ung thư ác tính (trừ ung thư bạch cầu tủy mạn tính và hội chứng loạn sản tủy).
3. Cách dùng – Liều dùng
– Cách dùng
Liều dùng
- Trị liệu bằng pegfilgrastim cần phải được bác sĩ có kinh nghiệm điều trị ung thư hay huyết học chỉ định và theo dõi.
- Mỗi liều 6 mg pegfilgrastim (bơm tiêm đơn liều đóng sẵn thuốc) được chỉ định dùng cho một chu kỳ hóa trị liệu tiêm dưới da cách 24 giờ sau khi dùng hóa trị liệu độc tế bào.
Bệnh nhân nhi
- Kinh nghiệm sử dụng ở trẻ em còn hạn chế (xem phần Tác dụng không mong muốn và Đặc tính dược động học).
- Tính an toàn và hiệu quả của pegfilgrastim ở trẻ em hiện chưa được thiết lập. Các dữ liệu hiện có mô tả trong các phần Tác dụng không mong muốn, Đặc tính dược lực học và Đặc tính dược động học nhưng chưa có khuyến cáo liều dùng cho trẻ.
Bệnh nhân suy thận
Không cần thay đổi liều cho bệnh nhân bị suy thận kể cả suy thận giai đoạn cuối.
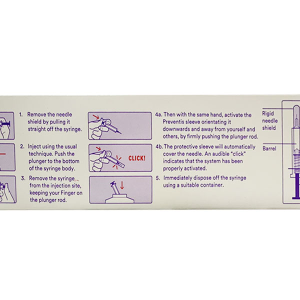
Cách dùng
- Hướng dẫn khi dùng thuốc
– Trước khi dùng, nên kiểm tra phần tử lạ trong dung dịch tiêm pegfilgrastim. Chỉ dung dịch trong suốt, không màu mới được tiêm.
– Lắc quá mức có thể gây kết tập pegfilgrastim, làm cho mất hoạt tính sinh học của thuốc.
– Để bơm tiêm đóng sẵn thuốc đạt nhiệt độ phòng trước khi tiêm.
- Đường dùng: Tiêm dưới da.
- Vị trí tiêm: Tiêm dưới da vào đùi, bụng hoặc cánh tay.
– Quá liều
Không có kinh nghiệm quá liều pegfilgrastim ở người.
4. Chống chỉ định
- Bệnh nhân quá mẫn với hoạt chất hoặc bất kỳ tá dược nào của thuốc.
- Bệnh nhân có tiền sử dị ứng với filgrastim.
5. Tác dụng phụ
Tóm tắt hồ sơ an toàn
- Các phản ứng bất lợi được báo cáo thường xuyên nhất là đau xương (rất phổ biến ≥ 1/10) và đau cơ xương khớp (phổ biến). Đau xương nói chung xảy ra ở mức độ từ nhẹ đến vừa phải, đau thoáng qua và có thể được kiểm soát ở hầu hết các bệnh nhân với thuốc giảm đau tiêu chuẩn.
- Phản ứng quá mẫn, bao gồm sốc phản vệ, phát ban da, nổi mề đay, phù mạch, khó thở, hạ huyết áp, phản ứng tại chỗ tiêm, ban đỏ và đỏ bừng, xảy ra khi điều trị ban đầu hoặc sau đó đã được báo cáo với pegfilgrastim không phổ biến (≥ 1/1.000 tới < 1/100) (xem phần Cảnh báo và thận trọng khi dùng thuốc).
- Hội chứng rò rỉ mao mạch, có thể đe dọa tính mạng nếu việc điều trị bị trì hoãn, đã được báo cáo là không phổ biến (≥ 1/1.000 đến <1/100) ở bệnh nhân ung thư trải qua hóa trị liệu sau khi sử dụng các yếu tố kích thích dòng bạch cầu hạt; xem phần Cảnh báo và thận trọng khi dùng thuốc và phần “Mô tả các phản ứng bất lợi chọn lọc” bên dưới.
- Các trường hợp không phổ biến nhưng thường không có triệu chứng của lách to và các trường hợp vỡ lách rất hiếm gặp, bao gồm một số trường hợp tử vong, đã được báo cáo sau khi sử dụng pegfilgrastim (xem phần Cảnh báo và thận trọng khi dùng thuốc).
- Tác dụng bất lợi trên phổi không phổ biến bao gồm viêm phổi kẽ, phù phổi, thâm nhiễm phổi và xơ phổi đã được báo cáo. Các trường hợp đã dẫn đến suy hô hấp hoặc Hội chứng suy hô hấp ở người trưởng thành (ARDS) không phổ biến, và có thể gây tử vong (xem phần Cảnh báo đặc biệt và thận trọng khi dùng thuốc).
- Các trường hợp riêng biệt của cơn tan máu do hồng cầu hình liềm đã được báo cáo ở những bệnh nhân mắc hồng cầu hình liềm thể nhẹ hoặc bệnh hồng cầu hình liềm (không phổ biến ở bệnh nhân bị bệnh hồng cầu hình liềm) (xem phần Cảnh báo và thận trọng khi dùng thuốc).
Bảng tóm tắt tổng hợp các phản ứng bất lợi
Dữ liệu trong bảng dưới đây mô tả các phản ứng bất lợi được báo cáo từ các thử nghiệm lâm sàng và báo cáo tự phát. Trong mỗi nhóm tần suất, các tác dụng không mong muốn được trình bày theo thứ tự giảm dần mức độ nghiêm trọng.
Phân loại cơ quan theo hệ thống MedDRA | Phản ứng bất lợi | ||||
Rất phổ biến (≥ 1/10) | Phổ biến (≥ 1/100 tới < 1/10) | Không phổ biến (≥ 1/1000 tới < 1/100) | Hiếm gặp (≥ 1/10000 tới < 1/1000) | Rất hiếm gặp (< 1/10000) | |
| Rối loạn hệ thống máu và bạch huyết | Giảm tiểu cầu1 Tăng bạch cầu1 | Cơn tan máu do hồng cầu hình liềm2 Lách to2 Vỡ lách2 | |||
| Rối loạn hệ thống miễn dịch | Phản ứng quá mẫn Sốc phản vệ | ||||
| Rối loạn dinh dưỡng và chuyển hóa | Tăng axit uric | ||||
| Rối loạn hệ thần kinh | Đau đầu1 | ||||
| Rối loạn mạch máu | Hội chứng rò rỉ mao mạch1 | ||||
| Rối loạn hô hấp, lồng ngực và trung thất | Hội chứng suy hô hấp cấp tính2 Phản ứng bất lợi trên phổi (viêm phổi kẽ, phù phổi, thâm nhiễm phổi và xơ phổi) | ||||
| Rối loạn tiêu hóa | Buồn nôn1 | ||||
| Rối loạn da và mô dưới da | Hội chứng Sweet (viêm da sốt cấp tính)1,2 Viêm mạch máu da1,2 | ||||
| Rối loạn cơ xương và mô liên kết | Đau xương | Đau cơ xương khớp (đau cơ, đau khớp, đau tứ chi, đau lưng, đau cơ xương, đau cổ) | |||
| Rối loạn chung và điều kiện tại chỗ tiêm | Đau chỗ tiêm1 Đau ngực không do tim | Phản ứng chỗ tiêm2 | |||
| Điều tra nghiên cứu | Tăng lactate dehydrogenase và kiềm phosphate1 Tăng LFT cho ALT hoặc AST tạm thời1 | ||||
| Rối loạn thận và tiết niệu | Viêm cầu thận2 | ||||
1Xem phần “Mô tả các phản ứng bất lợi chọn lọc” bên dưới.
2Phản ứng bất lợi này được xác định thông qua giám sát sau khi sử dụng trên thị trường nhưng không được quan sát trong các thử nghiệm lâm sàng ngẫu nhiên, có kiểm soát ở người lớn. Phân loại tần suất được ước tính từ một tính toán thống kê dựa trên 1576 bệnh nhân dùng pegfilgrastim trong chín thử nghiệm lâm sàng ngẫu nhiên.
Mô tả các phản ứng bất lợi chọn lọc
- Các ca không phổ biến của hội chứng Sweet đã được báo cáo, mặc dù trong một số trường hợp các khối u huyết học ác tính tiềm ẩn có thể đóng một vai trò trong đó.
- Các trường hợp không phổ biến của viêm mạch máu da đã được báo cáo ở những bệnh nhân được điều trị bằng pegfilgrastim. Cơ chế của viêm mạch máu ở bệnh nhân dùng pegfilgrastim vẫn chưa được biết đến.
- Phản ứng tại chỗ tiêm, bao gồm ban đỏ tại chỗ tiêm (không phổ biến (≥ 1/1000 đến <1/100)) cũng như đau tại chỗ tiêm (các biến cố thường gặp ≥ 1/100 đến < 1/10) đã xảy ra khi điều trị ban đầu hoặc sau đó bằng pegfilgrastim.
- Các trường hợp phổ biến (≥ 1/100 đến <1/10) của chứng tăng bạch cầu ([WBC] > 100 x 10^9/L) đã được báo cáo (xem phần Cảnh báo và thận trọng khi dùng thuốc).
- Ngược lại, tăng axit uric và phosphatase kiềm mức độ nhẹ đến trung bình, không liên quan đến các hiệu quả lâm sàng, là không phổ biến; tăng lactate dehydrogenase mức độ nhẹ đến trung bình có thể hồi phục, không có liên quan hiệu quả lâm sàng, xảy ra không phổ biến ở những bệnh nhân sử dụng pegfilgrastim sau hóa trị liệu độc tế bào.
- Buồn nôn và đau đầu rất thường gặp ở những bệnh nhân được hóa trị.
- Sự gia tăng không phổ biến trong các xét nghiệm chức năng gan (LFT) về ALT (alanine aminotransferase) hoặc AST (aspartate aminotransferase), đã được quan sát thấy ở bệnh nhân dùng pegfilgrastim sau hóa trị liệu độc tế bào. Sự gia tăng này là thoáng qua và có thể trở lại giá trị bình thường.
- Các trường hợp giảm tiểu cầu là phổ biến.
- Các trường hợp hội chứng rò rỉ mao mạch đã được báo cáo sau khi yếu tố kích thích dòng bạch cầu hạt được sử dụng trên thị trường. Những trường hợp này thường xảy ra ở những bệnh nhân mắc các bệnh ác tính tiến triển, nhiễm khuẩn huyết, dùng nhiều loại thuốc hóa trị hoặc trải qua quá trình phân tách thành phần máu (xem phần Cảnh báo và thận trọng khi dùng thuốc).
Trẻ em
Các tác dụng bất lợi nghiêm trọng ở trẻ nhỏ từ 0 – 5 tuổi (92%) đã được quan sát với tần suất cao hơn so với trẻ lớn hơn ở độ tuổi 6 – 11 và 12 – 21 tuổi (80% và 67%) và người lớn. Phản ứng bất lợi phổ biến nhất là đau xương (xem phần Đặc tính dược động học).
Người già
Trong số 932 bệnh nhân mắc bệnh ung thư đã sử dụng pegfilgrastim trong các nghiên cứu lâm sàng, 139 (15%) ở độ tuổi từ 65 trở lên và 18 (2%) ở độ tuổi 75 trở lên. Không có sự khác biệt tổng thể về an toàn hoặc hiệu quả đã được quan sát giữa bệnh nhân từ 65 tuổi trở lên và bệnh nhân trẻ tuổi.
Kinh nghiệm sau khi ra thị trường
Vỡ lách và lách to, hội chứng suy hô hấp cấp tính (ARDS), phản ứng dị ứng/quá mẫn, bao gồm sốc phản vệ, phát ban da, nổi mày đay, ban đỏ, và đỏ bừng, cơn tan máu do hồng cầu hình liềm, viêm cầu thận, tăng bạch cầu, hội chứng rò rỉ mao mạch, phản ứng tại chỗ tiêm, hội chứng Sweet (viêm da sốt cấp tính), viêm mạch máu da đã được xác định trong quá trình sử dụng pegfilgrastim sau khi được phê duyệt.
6. Lưu ý |
– Thận trọng khi sử dụng
Tác dụng bất lợi trên phổi
Viêm cầu thận Viêm cầu thận đã được báo cáo ở những bệnh nhân dùng filgrastim và pegfilgrastim. Nói chung, các sự kiện viêm cầu thận được giải quyết sau khi giảm liều hoặc ngưng filgrastim và pegfilgrastim. Khuyến cáo nên theo dõi kết quả xét nghiệm nước tiểu. Hội chứng rò rỉ mao mạch Hội chứng rò rỉ mao mạch đã được báo cáo sau khi sử dụng yếu tố kích thích dòng bạch cầu hạt và được đặc trưng bởi hạ huyết áp, giảm albumin huyết, phù nề và cô đặc máu. Bệnh nhân phát triển các triệu chứng của hội chứng rò mao mạch nên được theo dõi chặt chẽ và được điều trị triệu chứng theo tiêu chuẩn, có thể bao gồm nhu cầu chăm sóc đặc biệt (xem phần Tác dụng không mong muốn). Lách to và vỡ lách Các trường hợp không phổ biến nhưng thường không có triệu chứng của lách to và các trường hợp vỡ lách không phổ biến, bao gồm một số trường hợp tử vong, đã được báo cáo sau khi dùng pegfilgrastim (xem phần Tác dụng không mong muốn). Do đó, kích thước lách phải được theo dõi cẩn thận (ví dụ: khám lâm sàng, siêu âm). Cần xem xét chẩn đoán vỡ lách ở bệnh nhân báo cáo đau bụng trên bên trái hoặc đau đầu vai. Giảm tiểu cầu và thiếu máu
Thiếu máu hồng cầu hình liềm Các cơn tan máu do hồng cầu hình liềm có liên quan đến việc sử dụng pegfilgrastim ở những bệnh nhân mắc hồng cầu hình liềm thể nhẹ hoặc bệnh hồng cầu hình liềm (xem phần Tác dụng không mong muốn). Do đó, các bác sĩ nên thận trọng khi kê đơn thuốc pegfilgrastim ở bệnh nhân mắc hồng cầu hình liềm thể nhẹ hoặc bệnh hồng cầu hình liềm, nên theo dõi các thông số lâm sàng và kết quả xét nghiệm phù hợp và chú ý đến mối liên quan có thể của thuốc này với sự tăng kích thước lách và cơn tắc mạch. Tăng bạch cầu Số lượng tế bào bạch cầu (WBC) từ 100 x 109/L trở lên đã được quan sát thấy ở dưới 1% bệnh nhân dùng pegfilgrastim. Không có tác dụng phụ liên quan trực tiếp đến mức độ tăng bạch cầu này đã được báo cáo. Sự tăng cao như vậy ở các tế bào bạch cầu là thoáng qua, thường thấy sau 24 đến 48 giờ sau khi dùng và phù hợp với các tác dụng dược lực học của pegfilgrastim. Phù hợp với các tác dụng lâm sàng và khả năng tăng bạch cầu, xét nghiệm đếm số lượng WBC nên được thực hiện đều đặn trong suốt quá trình trị liệu. Nếu số lượng bạch cầu vượt quá 50 x 109/L sau điểm đáy dự kiến, nên ngừng thuốc này ngay lập tức. Quá mẫn Quá mẫn, bao gồm phản ứng phản vệ, xảy ra trong điều trị ban đầu hoặc sau đó đã được báo cáo ở những bệnh nhân được điều trị bằng pegfilgrastim. Ngừng vĩnh viễn pegfilgrastim ở những bệnh nhân quá mẫn cảm lâm sàng. Không dùng pegfilgrastim cho bệnh nhân có tiền sử mẫn cảm với pegfilgrastim hoặc filgrastim. Nếu một phản ứng dị ứng nghiêm trọng xảy ra, nên điều trị thích hợp, theo dõi chặt chẽ bệnh nhân trong vài ngày. Tính sinh miễn dịch Như với tất cả các protein điều trị, thuốc có khả năng gây miễn dịch. Tỷ lệ tạo kháng thể chống lại pegfilgrastim thường thấp. Gắn kết kháng thể xảy ra như dự kiến với tất cả các thuốc sinh phẩm; tuy nhiên, hiện tại chúng không liên quan đến hoạt động trung hòa. Viêm động mạch chủ
Tiềm năng tác dụng kích thích tăng trưởng khối u trên các tế bào ác tính Các thụ thể của yếu tố kích thích dòng bạch cầu hạt (G- CSF) thông qua hoạt động của pegfilgrastim và filgrastim đã được tìm thấy trên các dòng của tế bào khối u. Không thể loại trừ khả năng pegfilgrastim là yếu tố tăng trưởng cho bất kỳ loại khối u nào, bao gồm cả khối u ác tính và loạn sản tủy, những bệnh mà pegfilgrastim không được phê duyệt. – Thai kỳ và cho con búPhụ nữ có thai
Phụ nữ cho con bú Người ta không biết liệu pegfilgrastim có được tiết ra trong sữa mẹ hay không. Các sản phẩm G-CSF tái tổ hợp khác được tiết ra kém trong sữa mẹ và G-CSF không được hấp thụ bằng đường uống ở trẻ sơ sinh. Cần thận trọng khi dùng cho phụ nữ cho con bú. – Khả năng lái xe và vận hành máy mócHiện chưa có nghiên cứu về ảnh hưởng của thuốc lên khả năng lái xe và vận hành máy móc được thực hiện. – Tương tác thuốcTương tác
Tương kỵ Thuốc này không được trộn lẫn với thuốc khác, đặc biệt với dung dịch natri clorid. |
7. Dược lý
– Dược lực học (Tác động của thuốc lên cơ thể)
- Nhóm dược lý trị liệu: yếu tố kích thích miễn dịch, điều hòa dòng.
- Mã ATC: L03AA13.
- Yếu tố kích thích dòng bạch cầu hạt người (G-CSF) là một glycoprotein, có tác dụng điều hòa sản xuất và phóng thích bạch cầu trung tính từ tủy xương. Pegfilgrastim là hợp chất cộng hóa trị của yếu tố G-CSF tái tổ hợp của người (r-metHuG-CSF) với đơn phân tử PEG có khối lượng là 20kDa. Pegfilgrastim là dạng giải phóng chậm của filgrastim do giảm độ thanh thải qua thận. Pegfilgrastim và filgrastim được xem là có cơ chế tác động giống nhau, làm gia tăng số lượng bạch cầu trung tính đếm được ở máu ngoại vi trong 24 giờ và làm tăng chút ít đơn bào hay lympho bào. Tương tự như filgrastim, bạch cầu trung tính đáp ứng với tác động của pegfilgrastim có chức năng hoạt động bình thường hay tăng được chứng minh bởi thử nghiệm chức năng hóa ứng động và thực bào.
- Cũng như các yếu tố tăng trưởng tế bào tạo máu khác, G-CSF chứng tỏ có tác dụng kích thích tế bào nội bì người in vitro. G-CSF có thể thúc đẩy tăng trưởng của tế bào tủy, bao gồm tế bào ác tính in vitro và cho kết quả tương tự đối với một số tế bào khác không phải tế bào tủy.
Cơ chế tác động
Pegfilgrastim là một yếu tố kích thích dòng tế bào tác động trên tế bào tạo máu bằng cách gắn kết vào các thụ thể của tế bào đặc hiệu do đó kích thích sự phát triển, biệt hóa, chuyển giao và hoạt hóa chức năng tế bào đích.
– Dược động học (Tác động của cơ thể với thuốc)
- Sau khi tiêm dưới da đơn liều pegfilgrastim, nồng độ đỉnh huyết thanh đo được ở 16 giờ đến 120 giờ và duy trì trong thời gian giảm bạch cầu trung tính sau khi hóa trị liệu suy tủy. Thải trừ pegfilgrastim không tuyến tính so với liều dùng; độ thanh thải huyết thanh giảm khi liều dùng tăng. Pegfilgrastim chủ yếu được thải trừ qua trung gian bạch cầu trung tính và trở nên bão hòa ở liều cao. Phù hợp với cơ chế tự điều chỉnh sự thải trừ, nồng độ pegfilgrastim trong huyết thanh sẽ giảm nhanh khi số lượng bạch cầu trung tính được phục hồi (xem hình 1).
Hình 1: Nồng độ huyết thanh trung bình của pegfilgrastim và đếm bạch cầu trung tính tuyệt đối trong hóa trị liệu ở bệnh nhân sau khi tiêm đơn liều 6,0 mg.
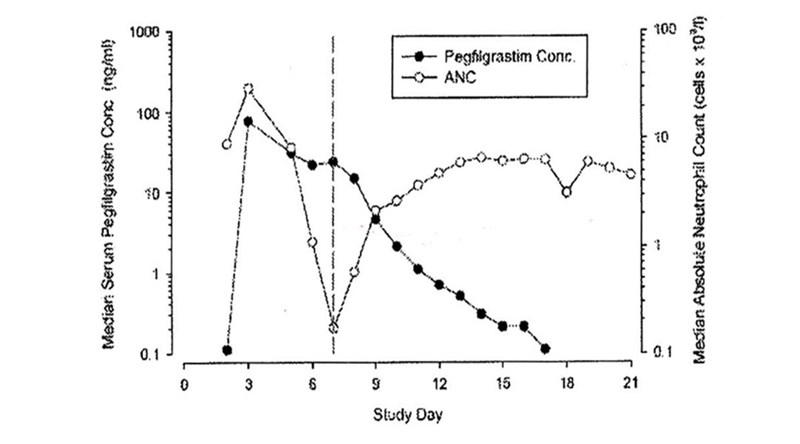
– Study Day: Ngày nghiên cứu.
– Median Serum Pegfilgrastim Conc. (ng/ml): Nồng độ pegfilgrastim huyết thanh trung bình (ng/ml).
– Median Absolute Neutrophil count (cell x 109/L): Bạch cầu trung tính tuyệt đối trung bình (tế bào x 109/L).
– Pegfilgrastim Conc.: Nồng độ pegfilgrastim.
– ANC: Bạch cầu trung tính tuyệt đối.
- Cũng do cơ chế thải trừ qua trung gian bạch cầu trung tính, dược động học của pegfilgrastim sẽ không bị ảnh hưởng bởi tình trạng gan suy hoặc thận suy. Trong thử nghiệm mở, dùng một liều duy nhất trên 31 bệnh nhân, với nhiều cấp độ suy thận khác nhau, kể cả tình trạng suy thận giai đoạn cuối cũng không làm ảnh hưởng đến dược động học của pegfilgrastim.
- Các dữ liệu còn hạn chế chứng tỏ dược động học của pegfilgrastim ở người già (> 65 tuổi) cũng tương tự như dược động học ở người lớn trưởng thành.
Bệnh nhân nhi
Dược động học của pegfilgrastim được khảo sát trên 37 trẻ em bị ung bướu, với liều 100µg/kg theo trọng lượng cơ thể, sau khi hoàn tất hóa trị liệu Vincristine-Adriamycin-Cyclophosphamid/ifosphamid-etoposid (V Adria C/IE). Trẻ nhỏ tuổi nhất (0 – 5 tuổi) phơi nhiễm trung bình với pegfilgrastim (có diện tích dưới đường cong AUC ± độ lệch chuẩn là 47,9 ± 22,5µg.giờ/mL) cao hơn là đối với trẻ lớn tuổi hơn 6 – 11 tuổi và 12 – 21 tuổi (lần lượt là 22,0 ± 13,1µg.giờ/mL và 29,3 ± 23,2µg.giờ/mL). Ngoại lệ, nhóm trẻ tuổi nhất (0 – 5 tuổi) trị số trung bình của diện tích dưới đường cong (AUC) của bệnh nhân nhi cũng tương tự như của bệnh nhân người lớn bị ung thư vú với nguy cơ cao ở giai đoạn II – IV và được điều trị với liều pegfilgrastim là 100µg/kg theo trọng lượng cơ thể sau khi hoàn tất sử dụng doxorubicin/docetaxel (xem Tác dụng không mong muốn).
8. Thông tin thêm
– Đặc điểm
Dung dịch trong suốt, không màu, không có các hạt nhìn thấy được.
– Bảo quản
- Bảo quản trong tủ lạnh 2 – 8 độ C.
- Không đông lạnh.
- Giữ thuốc trong hộp để tránh ánh sáng.
– Quy cách đóng gói
- 0,6 ml dung dịch tiêm trong bơm tiêm đóng sẵn thuốc (thủy tinh loại l) với nắp cao su và kim tiêm không rỉ đóng trong đồ bảo vệ tự động. Chỉ dùng 1 lần.
- Vỏ kim của bơm tiêm có chứa cao su thiên nhiên khô (dẫn xuất của latex) (xem phần Cảnh báo và thận trọng khi dùng thuốc).
- Hộp 1 bơm tiêm đóng sẵn thuốc 0,6 ml.
– Hạn dùng
24 tháng kể từ ngày sản xuất.
– Nhà sản xuất
Dr. Reddy’s Laboratories Ltd.















Đánh giá
Chưa có đánh giá nào.