| Toàn bộ thông tin dưới đây được Dược sĩ biên soạn lại dựa trên tờ Hướng dẫn sử dụng. Thông tin không thay đổi chỉ định dạng lại cho dễ đọc. |
1. Thành phần
Mỗi bơm tiêm đóng sẵn 5 ml dung dịch thuốc chứa:
- Hoạt chất: Fulvestrant 250 mg.
- Tá dược: Benzyl alcohol, alcohol, benzyl benzoat, castor oil.
2. Công dụng (Chỉ định)
Fulvestrant được chỉ định để điều trị cho phụ nữ sau mãn kinh mắc ung thư vú tiến triển khu trú hoặc di căn, có thụ thể estrogen dương tính chưa trị liệu trước bằng trị liệu nội tiết hay bị tái phát bệnh trong hoặc sau một trị liệu kháng estrogen bổ trợ, hoặc bệnh tiến triển trong quá trình trị liệu với một thuốc kháng estrogen.
3. Cách dùng – Liều dùng
– Cách dùng
Liều lượng
Phụ nữ trưởng thành (bao gồm cả người cao tuổi):
Khuyến cáo dùng liều 500 mg mỗi tháng, với một liều 500 mg bổ sung được thêm vào hai tuần sau liều đầu tiên.
Các đối tượng đặc biệt
Suy giảm chức năng thận
Không đề nghị hiệu chỉnh liều đối với các bệnh nhân có suy giảm chức năng thận từ nhẹ tới vừa (độ thanh thải creatinin > 30 ml/phút). Tính an toàn và hiệu lực hiện chưa được đánh giá ở các bệnh nhân có suy giảm chức năng thận nặng (độ thanh thải creatinin < 30 ml/phút), và do đó, đề nghị thận trọng đối với những bệnh nhân này.
Suy giảm chức năng gan
Không đề nghị hiệu chỉnh liều đối với các bệnh nhân có suy giảm chức năng gan từ nhẹ đến vừa. Tuy nhiên, do mức tiếp xúc với fulvestrant có thể gia tăng, fulvestrant nên được sử dụng một cách thận trọng ở những bệnh nhân này. Không có dữ liệu về các bệnh nhân có suy giảm chức năng gan nặng.
Trẻ em
Tính an toàn và hiệu lực của fulvestrant ở trẻ em từ sơ sinh đến 18 tuổi hiện chưa được thiết lập.
Cách dùng
- Fulvestrant nên được sử dụng dưới dạng hai liều tiêm 5 ml liên tiếp bằng cách tiêm bắp chậm (1 – 2 phút/lần tiêm), mỗi lần tiêm ở một bên mông.
- Cần thận trọng nếu tiêm fulvestrant ở vùng sau mông do gần với các dây thần kinh hông ở phía dưới.
Hướng dẫn sử dụng
- Sử dụng phương pháp tiêm theo các hướng dẫn tại địa phương đối với thực hiện tiêm bắp thể tích lớn.
- LƯU Ý: Do vị trí gần với các dây thần kinh hông phía dưới, cần thận trọng nếu tiêm fulvestrant ở vùng sau mông.
- Cảnh báo: Không hấp kim tiêm an toàn (Kim tiêm dưới da an toàn SurGuard® 3) trước khi sử dụng. Bàn tay phải luôn đặt phía sau kim trong suốt thời gian sử dụng và thải bỏ.
- Đối với mỗi ống tiêm:
– Tháo nắp ống tiêm bằng thủy tinh ra khỏi Figure thân ống và kiểm tra rằng ống tiêm không bị hư hỏng.
– Mở rung bao bì bên ngoài kim tiêm an toàn.
– Dung dịch tiêm phải được kiểm tra bằng mắt đối với các hạt vật chất và màu của dung dịch trước khi dùng.
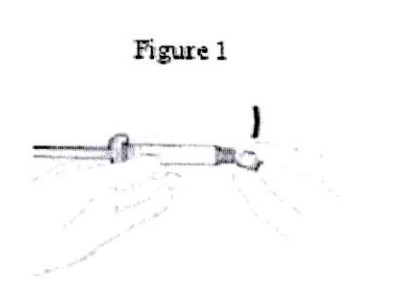
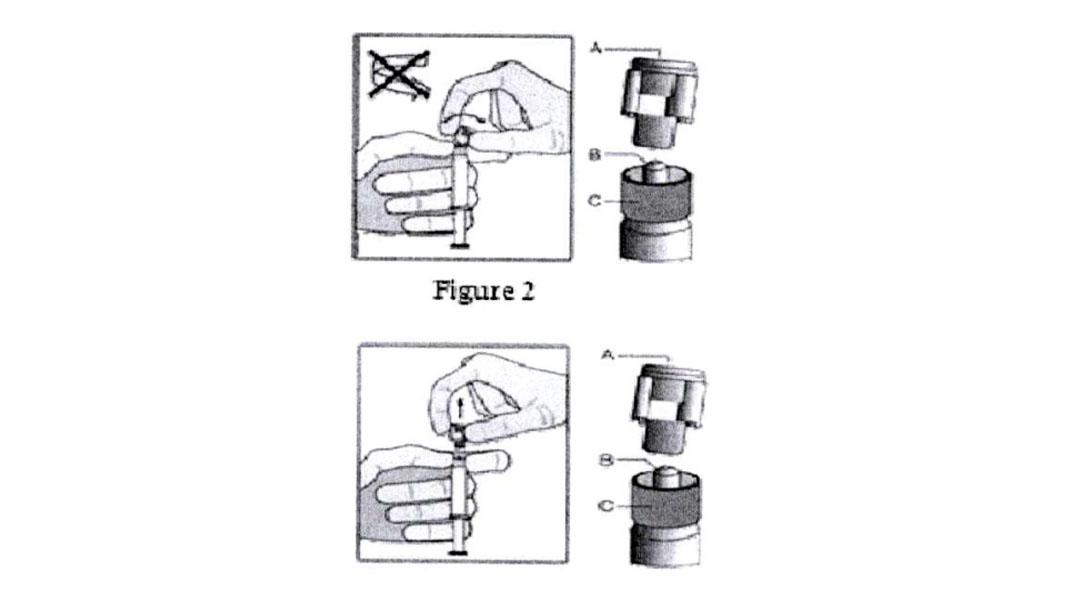
– Cầm ống tiêm thẳng đứng trên phần gờ nổi (C).
– Tay còn lại giữ chặt nắp (A) và nghiêng qua lại cẩn thận cho tới khi nắp rời và có thể kéo được ra, không vặn xoắn (Xem hình 1).
– Bỏ nắp (A) theo chiều thẳng lên trên.
– Để duy trì tính vô trùng, không chạm vào mũi tiêm (B) (xem Hình 2).
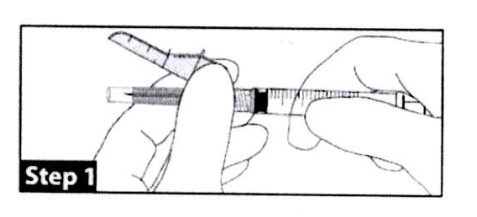
Bước 1
Gắn chặt ống tiêm vào kim tiêm sử dụng kỹ thuật vô trùng. Kẹp chặt chân kim tiêm, không phải vỏ bọc an toàn, đẩy và xoay ống tiêm theo chiều kim đồng hồ.
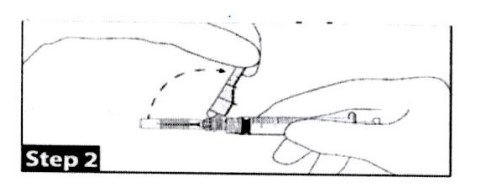
Bước 2
Tháo vỏ bọc an toàn ra khỏi kim tiêm và hướng về phía nắp ống tiêm tạo thành góc nghiêng, trước khi tháo nắp kim tiêm. Thực hiện thao tác tiêm theo kỹ thuật đã được thiết lập.
(Lưu ý: Vị trí “tạo góc lên” của kim tiêm được hướng đến vị trí của vỏ bọc an toàn.)
Bước 3
Sau thao tác tiêm, sử dụng kỹ thuật một tay để kích hoạt cơ chế an toàn sử dụng một trong ba (3) phương pháp được minh họa dưới đây.
(Sự kích hoạt được xác định bằng một âm thanh hoặc cảm giác bằng xúc giác “click”, và có thể được xác nhận trực quan.)
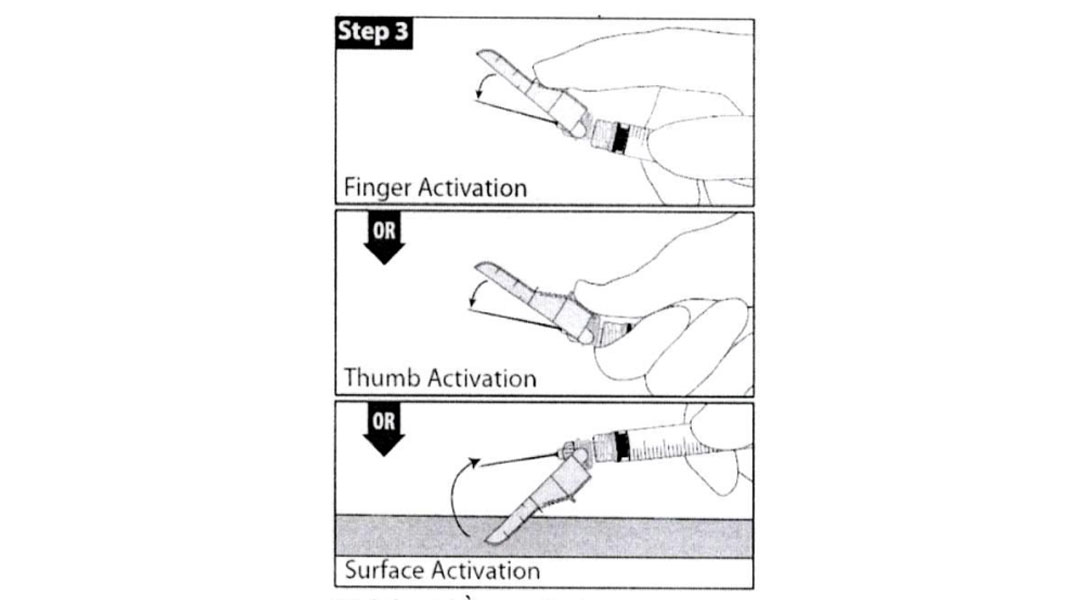
Kích hoạt bằng ngón tay.
Kích hoạt băng ngón cái.
Kích hoạt bề mặt.
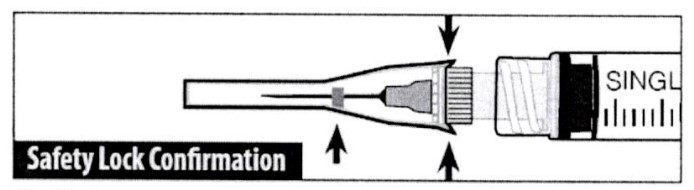
Bước 4
Xác nhận trực quan rằng vỏ bọc an toàn đã được gắn chặt.
Thải bỏ
- Các ống tiêm chứa sẵn thuốc chỉ sử dụng một lần duy nhất.
- Mọi sản phẩm thuốc không sử dụng hoặc nguyên liệu thừa cần được thải bỏ phù hợp với yêu cầu của địa phương.
– Quá liều
Hiện chưa có trường hợp quá liều trên người nào được ghi nhận. Các nghiên cứu trên động vật cho thấy không có tác dụng nào ngoài các tác dụng có liên quan trực tiếp hoặc gián tiếp đến hoạt tính kháng estrogen là rõ ràng với các liều fulvestrant cao hơn. Nếu xảy ra quá liều, điều trị hỗ trợ về mặt triệu chứng được đề nghị.
4. Chống chỉ định
- Quá mẫn với hoạt chất hoặc với bất kỳ thành phần nào của thuốc.
- Phụ nữ mang thai và cho con bú
- Suy giảm chức năng gan nặng.
5. Tác dụng phụ
- Mục này cung cấp các thông tin dựa trên tất cả các phản ứng bất lợi từ các thử nghiệm lâm sàng, các nghiên cứu sau khi đưa thuốc ra thị trường hoặc các báo cáo tự phát. Các phản ứng bất lợi được báo cáo thường xuyên nhất là các phản ứng tại nơi tiêm, suy nhược, buồn nôn, và tăng men gan (ALT, AST, ALP).
- Các loại phản ứng bất lợi do thuốc (ADRs) theo tần suất sau đây được tính toán dựa trên nhóm điều trị với liều fulvestrant 500 mg trong các phân tích về tính an toàn gộp của các nghiên cứu C-O-N-F-I-R-M (Nghiên cứu D6997C00002), FINDER 1 (Nghiên cứu D6997C00004), FINDER 2 (Nghiên cứu D6997C00006), và NEWEST (Nghiên cứu D6997C00003) mà so sánh fulvestrant 500 mg với fulvestrant 250 mg. Tần suất trong bảng dưới đây được dựa trên tất cả các biến cố đã được báo cáo, bất kể đánh giá của nghiên cứu viên về quan hệ nhân quả.
- Các phản ứng bất lợi được liệt kê dưới đây được phân loại theo tần suất và hệ cơ quan cơ thể (SOC). Các nhóm tần suất được xác định theo quy ước sau: Rất thường gặp (≥ 1/10), Thường gặp (≥ 1/100 tới <1/10), Ít gặp (≥ 1/1000 tới <1/100). Trong mỗi nhóm tần suất các phản ứng bất lợi được báo cáo theo thứ tự giảm dần mức độ nghiêm trọng.
Bảng 1. Các phản ứng bất lợi do thuốc
| Các phản ứng bất lợi theo hệ cơ quan cơ thể và tần suất | ||
| Nhiễm khuẩn và nhiễm ký sinh trùng | Thường gặp | Nhiễm khuẩn đường tiết niệu |
| Các rối loạn về máu và hệ bạch huyết | Ít gặp | Giảm số lượng tiểu cầu |
| Các rối loạn hệ miễn dịch | Thường gặp | Các phản ứng quá mẫn |
| Các rối loạn chuyển hóa và dinh dưỡng | Thường gặp | Biếng ăna |
| Các rối loạn hệ thần kinh | Thường gặp | Đau đầu |
| Các rối loạn mạch máu | Thường gặp | Huyết khối tĩnh mạcha, đỏ bừng |
Các rối loạn tiêu hóa | Rất thường gặp | Buồn nôn |
| Thường gặp | Nôn, tiêu chảy | |
Các rối loạn gan mật | Rất thường gặp | Tăng enzym gan (ALT, AST, ALP)a |
| Thường gặp | Tăng bilirubina | |
| Ít gặp | Suy ganc, viêm ganc, tăng gamma-GT | |
| Các rối loạn ở da và mô dưới da | Thường gặp | Ban da |
| Các rối loạn cơ xương và mô liên kết | Thường gặp | Đau lưnga |
| Các rối loạn hệ sinh sản và vú | Ít gặp | Bệnh do Monilia âm đạo, huyết trắng, xuất huyết âm đạo |
Các rối loạn chung và tình trạng nơi dùng thuốc | Rất thường gặp | Suy nhượca, các phản ứng tại nơi tiêmb |
| Ít gặp | Xuất huyết tại nơi tiêm, tụ máu tại nơi tiêm, đau dây thần kinh hông, đau thần kinhc, bệnh thần kinh ngoại biên | |
a Bao gồm các phản ứng bất lợi do thuốc mà trong đó sự góp phần của fulvestrant không thể đánh giá được chính xác do bệnh lý tiềm ẩn.
b Thuật ngữ các phản ứng tại nơi tiêm không bao gồm thuật ngữ xuất huyết tại nơi tiêm, tụ máu tại nơi tiêm, đau dây thần kinh hông, đau thần kinh, bệnh thần kinh ngoại biên.
c Biến cố không được quan sát thấy trong các nghiên cứu lâm sàng lớn (C-O-N-F-I-R-M, FINDER 1; FINDER 2, NEWEST). Tần suất được tính toán sử dụng giới hạn trên của khoảng tin cậy 95% đối với ước tính điểm. Tần suất được tính là 3/560 (trong đó 560 là số bệnh nhân trong các nghiên cứu lâm sàng lớn), tương đương với loại tần suất là “ít gặp”.
6. Lưu ý |
– Thận trọng khi sử dụng
Gây nhiễu đối với các xét nghiệm kháng thể estradiol Do fulvestrant có cấu trúc tương tự với estradiol, fulvestrant có thể gây nhiễu đối với các xét nghiệm kháng thể có sử dụng estradiol và có thể dẫn đến sự tăng sai nồng độ estradiol. Đối tượng trẻ em Fulvestrant không được đề nghị sử dụng cho trẻ em và thanh thiếu niên do tính an toàn và hiệu lực hiện chưa được thiết lập trong nhóm các bệnh nhân này. – Thai kỳ và cho con búPhụ nữ có khả năng sinh con Các bệnh nhân có khả năng sinh con nên được tư vấn về cách sử dụng các biện pháp tránh thai hiệu quả trong quá trình điều trị. Mang thai Fulvestrant được chống chỉ định trong thai kỳ. Fulvestrant đã được chứng minh đi qua được nhau thai sau khi tiêm bắp các liều duy nhất trên chuột cống và thỏ. Các nghiên cứu trên động vật đã chứng minh độc tính sinh sản bao gồm tăng tỷ lệ phát sinh các bất thường và tử vong ở thai nhi. Nếu xảy ra mang thai trong quá trình dùng fulvestrant, bệnh nhân cần được thông báo về những nguy cơ độc hại tiềm ẩn đối với thai nhi và nguy cơ tiềm ẩn về việc mất thai trong thai kỳ. Cho con bú Phải ngừng cho con bú trong quá trình điều trị với fulvestrant. Fulvestrant được thải trừ qua sữa ở các con chuột cống cho con bú. Hiện vẫn chưa rõ liệu fulvestrant có được thải trừ qua sữa mẹ hay không. Cân nhắc khả năng xảy ra đối với các phản ứng có hại nghiêm trọng do fulvestrant ở trẻ bú mẹ, chống chỉ định dùng thuốc khi đang cho con bú. Khả năng sinh sản Ảnh hưởng của fulvestrant lên khả năng sinh sản ở người hiện chưa được nghiên cứu. – Khả năng lái xe và vận hành máy mócFulvestrant không có hoặc có ảnh hưởng không đáng kể đến khả năng lái xe hoặc vận hành máy móc. Tuy nhiên, do suy nhược đã được báo cáo rất thường gặp khi dùng fulvestrant, các bệnh nhân gặp phải phản ứng bất lợi này cần thận trọng khi lái xe hoặc vận hành máy móc. – Tương tác thuốcMột nghiên cứu tương tác trên lâm sàng với midazolam (chất nền của CYP3A4) đã chứng minh rằng fulvestrant không ức chế CYP3A4. Các nghiên cứu tương tác trên lâm sàng với rifampicin (chất cảm ứng CYP3A4) và ketoconazol (chất ức chế CYP3A4) cho thấy không có thay đổi có liên quan về mặt lâm sàng nào trong độ thanh thải của fulvestrant. Do đó hiệu chỉnh liều là không cần thiết ở những bệnh nhân đang nhận được đồng thời fulvestrant và các thuốc ức chế hoặc cảm ứng CYP3A4. |
7. Dược lý
– Dược lực học (Tác động của thuốc lên cơ thể)
- Fulvestrant là một thuốc đối kháng cạnh tranh thụ thể estrogen (ER) với một ái lực tương tự với estradiol. Fulvestrant ngăn cản hoạt động dinh dưỡng của các oestrogen mà không cần bất kỳ hoạt tính (tương tự estrogen) chủ vận từng phần nào. Cơ chế hoạt động liên quan đến sự điều chỉnh giảm các mức độ protein thụ thể estrogen.
- Các thử nghiệm lâm sàng ở phụ nữ sau mãn kinh bị ung thư vú nguyên phát đã cho thấy rằng fulvestrant điều chỉnh giảm protein ER rõ rệt trong các khối u có ER dương tính so với giả dược. Ngoài ra còn có một sự giảm đáng kể trong biểu hiện thụ thể progesteron phù hợp với sự thiếu ảnh hưởng estrogen chủ vận nội tại. Điều này cũng đã được chứng minh rằng fulvestrant 500 mg điều chỉnh giảm ER và chỉ dấu tăng sinh Ki67, ở mức độ cao hơn so với fulvestrant 250 mg trong các khối u ở vú trong điều trị hỗ trợ sau mãn kinh.
– Dược động học (Tác động của cơ thể với thuốc)
Hấp thu
Sau khi dùng fulvestrant dưới dạng tiêm bắp tác dụng đài, fulvestrant được hấp thu chậm và các nồng độ trong huyết tương tối đa (Cmax) đã đạt được sau khoảng 5 ngày. Việc sử dụng phác đồ fulvestrant 500 mg đạt được hoặc gần đạt nồng độ trung bình ở trạng thái ổn định trong cơ thể trong tháng dùng liều đầu tiên ([CV] trung bình tương ứng: AUC 475 [33,4%]ng.ngày/ml, Cmax 25,1 [35,33%] ng/ml, Cmin 16,3 [25,9%] ng/ml). Tại trạng thái ổn định, các nồng độ trong huyết tương của fulvestrant được duy trì trong một khoảng tương đối hẹp, chênh lệch giữa nồng độ đỉnh và nồng độ đáy xấp xỉ 3 lần. Sau khi tiêm bắp, nồng độ trong cơ thể là xấp xỉ tỷ lệ với liều trong khoảng liều từ 50 đến 500 mg.
Phân bố
Fulvestrant có khả năng phân bố nhanh chóng và rộng. Thể tích phân bố lớn rõ ràng ở trạng thái ổn định (Vdss) là khoảng từ 3 đến 5 L/kg cho thấy rằng sự phân bố chủ yếu ở ngoại mạch. Fulvestrant liên kết mạnh (99%) với các protein huyết tương. Các phân đoạn lipoprotein tỷ trọng rất thấp (VLDL), lipoprotein tỷ trọng thấp (LDL), và lipoprotein tỷ trọng cao (HDL) là các thành phần liên kết chính. Không có các nghiên cứu về tương tác nào đã được tiến hành về liên kết cạnh tranh với protein. Vai trò của globulin liên kết nội tiết tố sinh dục (SHBG) hiện chưa được xác định.
Chuyển đổi sinh học
Sự chuyển hóa của fulvestrant hiện chưa được đánh giá đầy đủ, nhưng có liên quan đến sự kết hợp một số các con đường chuyển đổi sinh học có thể tương đồng với các con đường chuyển đổi sinh học của các steroid nội sinh. Các chất chuyển hóa được xác định (bao gồm các chất chuyển hóa 17-keton, sulphon, 3-sulphat, 3- và 17-glucuronid) có hoạt tính kém hơn hoặc thể hiện hoạt tính tương tự với fulvestrant trong các mô hình kháng estrogen. Các nghiên cứu sử dụng các chế phẩm từ gan người và các enzym tái tổ hợp của người đã chỉ ra rằng CYP3A4 là đồng enzym P450 duy nhất tham gia vào quá trình oxy hóa của fulvestrant; tuy nhiên các con đường không qua P450 dường như không chiếm ưu thế hơn trong nghiên cứu vivo. Dữ liệu in vitro cho thấy rằng fulvestrant không ức chế các đồng enzym CYP450.
Thải trừ
Fulvestrant được thải trừ chủ yếu ở dạng đã chuyển hóa. Đường thải trừ chính là qua phân, với dưới 1% được thải trừ qua nước tiêu. Fulvestrant có một mức độ thanh thải cao, 11 ± 1,7ml/phút/kg, cho thấy có một tỷ lệ thải trừ qua gan cao. Thời gian bán thải (t1⁄2) sau tiêm bắp bị chỉ phối bởi tỷ lệ hấp thu và được ước tính là 50 ngày.
Các đối tượng đặc biệt
Trong một phân tích dược động học quần thể về dữ liệu từ các nghiên cứu giai đoạn III, không phát hiện có sự khác biệt giữa mô tả sơ lược về dược động học của fulvestrant về lứa tuổi (phạm vi từ 33 đến 89 tuổi), cân nặng (từ 40 đến 127 kg) hoặc chủng tộc.
Suy giảm chức năng thận
Suy giảm chức năng thận từ nhẹ đến vừa không ảnh hưởng đến dược động học của fulvestrant tới mọi mức độ có liên quan về mặt lâm sàng.
Suy giảm chức năng gan
Dược động học của fulvestrant được đánh giá trong một thử nghiệm lâm sàng liều duy nhất đã được tiến hành trên các đối tượng có suy giảm chức năng gan từ nhẹ đến vừa (nhóm Child-Pugh A và B). Một công thức tiêm bắp liều cao trong thời gian ngắn hơn đã được sử dụng. Có một sự gia tăng AUC lên tới khoảng 2.5 lần ở các đối tượng suy giảm chức năng, gan so với các đối tượng khỏe mạnh. Ở các bệnh nhân được dùng fulvestrant, sự gia tăng nồng độ trong cơ thể ở mức độ này được dự kiến là dung nạp tốt. Các đối tượng suy giảm chức năng gan nặng (nhóm Child-Pugh C) không được đánh giá ở dây.
Trẻ em
Dược động học của fulvestrant đã được đánh giá trong một thử nghiệm lâm sàng được tiến hành trên 30 bé gái mắc dậy thì sớm tiến triển liên quan đến hội chứng McCune Albright. Các bệnh nhân trẻ em có độ tuổi từ 1 đến 8 tuổi và được nhận liều 4 mg/kg fulvestrant tiêm bắp hàng tháng. Trung bình nhân (độ lệch chuẩn) nồng độ đáy ở trạng thái ổn định (Cmin, ss) và AUCss tương ứng là 4,2 (0,9) ng/mL và 3680 (1020) ng*hr/mL. Mặc dù các dữ liệu thu thập được bị hạn chế, các nồng độ đáy ở trạng thái ổn định của fulvestrant trên trẻ em dường như phù hợp với các nồng độ đáy ở trạng thái ổn định trên người lớn.
8. Thông tin thêm
– Đặc điểm
Dung dịch tiêm.
– Bảo quản
- Bảo quản trong tủ lạnh (2 độ C – 8 độ C). Không đông lạnh.
- Giữ bơm tiêm trong hộp thuốc để tránh ánh sáng.
– Quy cách đóng gói
Hộp chứa 2 bơm tiêm đóng sẵn thuốc và 2 kim tiêm.
– Hạn dùng
24 tháng kể từ ngày sản xuất.
– Nhà sản xuất
Dr. Reddy’s Laboratories Ltd.










Đánh giá
Chưa có đánh giá nào.