| Mọi thông tin dưới đây đã được Dược sĩ biên soạn lại. Tuy nhiên, nội dung hoàn toàn giữ nguyên dựa trên tờ Hướng dẫn sử dụng, chỉ thay đổi về mặt hình thức. |
1. Thành phần
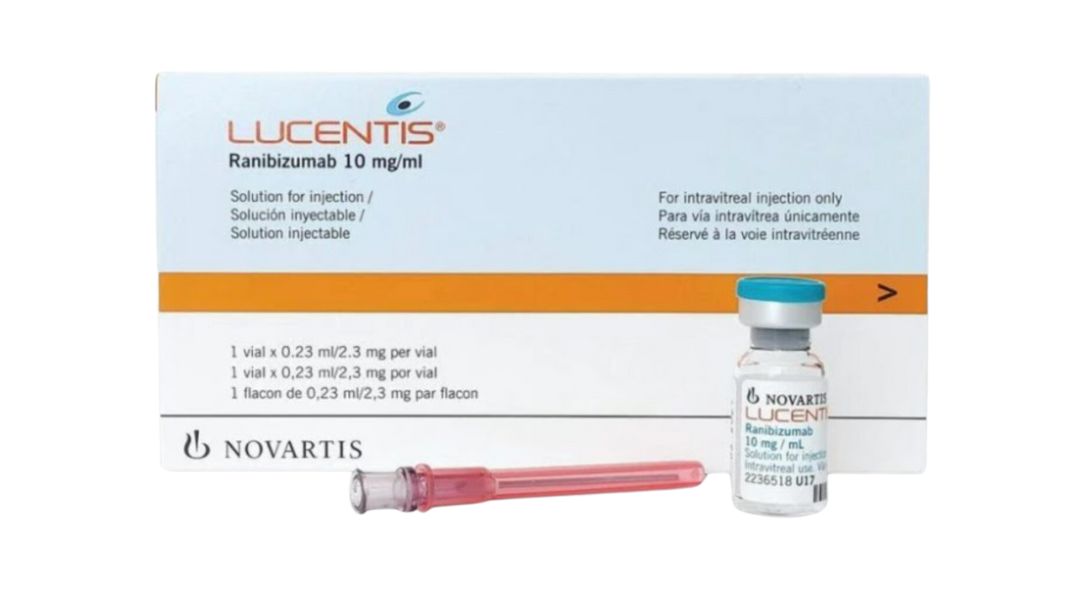
Mỗi lọ dung dịch tiêm Lucentis 2.3 mg/0.23 ml chứa 2.3 mg Ranibizumab trong 0.23 ml dung dịch.
2. Công dụng (Chỉ định)
Điều trị thoái hóa hoàng điểm tân mạch (thể ướt) do tuổi già (wAMD); suy giảm thị lực bởi phù hoàng điểm do đái tháo đường (DME); suy giảm thị lực bởi phù hoàng điểm thứ phát do tắc tĩnh mạch nhánh võng mạc (BRVO) hoặc tắc tĩnh mạch võng mạc trung tâm (CRVO); suy giảm thị lực do tân mạch hắc mạc thứ phát sau cận thị bệnh lý (mCNV).
3. Cách dùng – liều dùng
– Cách dùng
Phải kiểm tra kỹ Lucentis bằng mắt về các phân tử nhỏ và sự đổi màu trước khi sử dụng.
Thủ thuật tiêm phải được thực hiện trong điều kiện vô khuẩn, bao gồm việc sử dụng các chất khử khuẩn bàn tay dùng trong phẫu thuật, găng vô khuẩn, vải phủ vô khuẩn và banh mí mắt vô khuẩn (hoặc dụng cụ tương đương) và có sẵn dụng cụ chọc hút vô khuẩn (nếu cần).
Cần đánh giá cẩn thận tiền sử phản ứng quá mẫn của bệnh nhân trước khi thực hiện thủ thuật tiêm trong dịch kính.
Cần gây tê đầy đủ và sử dụng thuốc diệt khuẩn dùng tại chỗ phổ rộng để khử khuẩn da quanh mắt, mí mắt và bề mặt của mắt trước khi tiêm.
Kim tiêm nên được cắm sâu 3,5-4mm phía sau rìa vào trong khoang dịch kính, tránh kinh tuyến ngang và hướng về trung tâm nhãn cầu. Sau đó bơm vào 0,05 ml, nên luân phiên vị trí tiêm trên củng mạc mắt cho những mũi tiêm tiếp theo.
– Liều dùng
Liều Lucentis được khuyến cáo là 0,5 mg tương đương cho một thể tích tiêm 0,05 ml, được tiêm một lần trong dịch kính.
Khoảng cách giữa hai liều tiêm trong cùng một mắt ít nhất là 4 tuần.
Nhóm bệnh nhân mục tiêu nói chung: Điều trị wAMD, DME, RVO, mCNV: Việc điều trị được bắt đầu với một mũi tiêm mỗi tháng cho đến khi đạt được thị lực tối đa và/hoặc không có dấu hiệu hoạt động của bệnh. Sau đó, khoảng cách theo dõi và điều trị nên được bác sĩ xác định và cần dựa trên hoạt động của bệnh thông qua việc đánh giá thị lực và/hoặc các thông số giải phẫu.
Nếu bệnh nhân đang được điều trị theo phác đồ điều trị và mở rộng (treat-and-extend), một khi đạt được thị lực tối ưu và/hoặc không có các dấu hiệu hoạt động của bệnh, khoảng cách điều trị có thể được mở rộng từng bước cho đến khi có các dấu hiệu hoạt động của bệnh hoặc suy giảm thị lực tái phát.
Khoảng cách điều trị nên được mở rộng thêm không quá hai tuần một lần đối với thoái hóa hoàng điểm liên quan đến tuổi già thể ướt (wAMD) và có thể mở rộng thêm lên đến 1 tháng một lần đối với phù hoàng điểm do đái tháo đường (DME).
Đối với tắc tĩnh mạch võng mạc (RVO), khoảng cách điều trị có thể được mở rộng dần, tuy nhiên chưa có đầy đủ dữ liệu để kết luận về độ dài của các khoảng cách điều trị. Nếu hoạt động của bệnh tái phát, nên rút ngắn khoảng cách điều trị cho phù hợp.
Trong điều trị suy giảm thị lực do tân mạch hắc mạc thứ phát sau cận thị bệnh lý (mCNV), nhiều bệnh nhân có thể chỉ cần một hoặc hai mũi tiêm trong năm đầu điều trị, trong khi một số bệnh nhân có thể cần được điều trị với tần suất thường xuyên hơn. Lucentis có thể dùng cho bệnh nhân đã dùng phương pháp laser quang đông trước đó. Khi dùng trong cùng ngày, Lucentis nên được dùng ít nhất 30 phút sau khi laser quang đông.
– Đối tượng đặc biệt
- Không có giới hạn đặc biệt nào được xem là cần thiết với nhóm bệnh nhân suy gan
- Không cần điều chỉnh liều ở nhóm bệnh nhân suy thận.
- Không khuyến cáo dùng Lucentis cho trẻ em và thiếu niên.
- Không cần điều chỉnh liều ở người cao tuổi, kinh nghiệm sử dụng còn hạn chế ở bệnh nhân DME trên 75 tuổi.
4. Chống chỉ định
Lucentis 2.3mg/0.23ml chống chỉ định trong các trường hợp:
- Quá mẫn với ranibizumab hoặc với bất kỳ thành phần nào của thuốc.
- Bệnh nhân có nhiễm khuẩn mắt hoặc quanh mắt đang hoạt động hoặc nghi ngờ.
- Bệnh nhân đang bị viêm trong nhãn cầu.
5. Tác dụng phụ
Toàn thân bao gồm cả xuất huyết ngoài mắt và huyết khối động mạch đã được báo cáo, cần cẩn thận khi điều trị cho bệnh nhân DME và phù hoàng điểm do RVO có tiền sử đột quỵ hoặc cơn thiếu máu thoáng qua.
| Các biến cố bất lợi rất thường gặp | Viêm trong nhãn cầu, viêm dịch kính, bong dịch kính, xuất huyết võng mạc, rối loạn thị giác, đau mắt, hiện tượng ruồi bay, xuất huyết kết mạc, kích ứng mắt, cảm giác có dị vật trong mắt, chảy nước mắt nhiều, viêm mí mắt, khô mắt, xuất huyết mắt, ngứa mắt, tăng nhãn áp, viêm mũi họng, nhức đầu, đau khớp. |
| Các biến cố bất lợi thường gặp | Thoái hóa võng mạc, rối loạn võng mạc, rách biểu mô sắc tố võng mạc, giảm thị lực, xuất huyết dịch kính, rối loạn dịch kính, viêm màng bồ đào, viêm mống mắt, viêm mống mắt-thể mi, đục thủy tinh thể, đục thủy tinh thể dưới bao, đục bao sau, viêm giác mạc dạng chấm, trầy giác mạc, tiền phòng vẩn đục, nhìn mờ, chảy máu chỗ tiêm, chảy máu mắt, viêm kết mạc, viêm kết mạc dị ứng, chảy ghèn, sợ ánh sáng, nhức mắt, phù mí mắt, đau mí mắt, xung huyết kết mạc, đột quỵ, cúm, nhiễm trùng tiểu*, thiếu máu, lo âu, ho, buồn nôn, phản ứng dị ứng (nổi mẩn, ngứa, mề đay, da đỏ). |
| Các biến cố bất lợi ít gặp | Mù mắt, viêm nội nhãn, mủ tiền phòng, ngấn máu tiền phòng, bệnh giác mạc, dính mống mắt, lắng đọng giác mạc, phù giác mạc, giác mạc có vân, đau chỗ tiêm, cảm giác bất thường trong mắt, kích ứng mí mắt. |
| Các biến cố bất lợi nghiêm trọng | Liên quan đến tiêm nội nhãn bao gồm viêm nội nhãn, bong giác mạc, rách giác mạc đục thủy tinh thể do chấn thương trong điều trị. |
| (*) Chỉ quan sát được trên bệnh nhân DME | |
Các tác dụng phụ thường gặp nhất từ các báo cáo này là tăng áp lực nội nhãn và đau mắt. Nếu xảy ra quá liều phải theo dõi áp lực nội nhãn và được điều trị bởi thầy thuốc nếu thấy cần thiết.
6. Lưu ý |
– Thận trọng khi sử dụngTiêm nội nhãn có thể gây viêm nội nhãn, tăng nhãn áp, bong võng mạc, rách võng mạc, và đục thủy tinh thể do chấn thương trong điều trị. Do đó, phải áp dụng nghiêm ngặt kỹ thuật tiêm vô khuẩn. Phải theo dõi bệnh nhân trong tuần lễ đầu sau tiêm để có thể điều trị sớm nếu xảy ra nhiễm khuẩn. Tăng nhãn áp thoáng qua đã được nhận thấy trong vòng 60 phút sau tiêm Lucentis. Tăng nhãn áp kéo dài cũng đã được báo cáo. Phải theo dõi nhãn áp và sự tưới máu ở đầu dây thần kinh thị giác và xử trí thích hợp. Có nguy cơ tiềm năng xảy ra biến cố thuyên tắc huyết khối động mạch sau khi dùng thuốc ức chế VEGF trong nhãn cầu. Một tỉ lệ đột quỵ cao hơn đã được ghi nhận trên bệnh nhân điều trị ranibizumab 0,5 mg so với ranibizumab 0,3 mg hoặc nhóm đối chứng, tuy vậy, sự khác biệt không có ý nghĩa thống kê. Bệnh nhân có các nguy cơ đã biết của đột quỵ, bao gồm tiền sử đột quỵ hoặc cơn thoáng thiếu máu não cần được bác sĩ đánh giá cẩn thận xem có thích hợp để điều trị với Lucentis hay không và lợi ích có trội hơn nguy cơ tiềm năng hay không. Như tất cả các loại thuốc protein khác, Lucentis có tiềm năng gây phản ứng miễn dịch. Việc sử dụng Lucentis đồng thời trên cả 2 mắt (bao gồm việc dùng trong cùng 1 ngày) không cho thấy nguy cơ tăng các biến cố bất lợi toàn thân so với khi điều trị trên 1 mắt. Cẩn trọng khi bắt đầu điều trị Lucentis cho bệnh nhân AMD có nguy cơ rách biểu mô sắc tố võng mạc bao gồm bong biểu mô sắc tố võng mạc diện rộng và/hoặc mức độ cao. Nên ngưng điều trị ở những bệnh nhân bị bong võng mạc do vết rách hoặc lỗ hoàng điểm giai đoạn 3 và 4. Không nên dùng đồng thời Lucentis với các thuốc kháng VEGF khác. Bệnh nhân có tiền sử RVO, RVO nhánh thiếu máu và RVO trung tâm: Không khuyến cáo điều trị ở bệnh nhân RVO có các dấu hiệu lâm sàng của thiếu máu cục bộ không hồi phục, mất chức năng thị giác. – Phụ nữ có thai và cho con búPhụ nữ có khả năng mang thai Phụ nữ có khả năng mang thai nên dùng phương pháp tránh thai hiệu quả khi điều trị. Phụ nữ có thai
Phụ nữ cho con bú Chưa rõ Lucentis có được bài tiết qua sữa mẹ hay không. Để đề phòng, khuyến cáo không cho con bú mẹ trong thời gian sử dụng Lucentis. Khả năng sinh sản Chưa có dữ liệu về ảnh hưởng đến khả năng sinh sản. – Khả năng lái xe và vận hành máy mócThủ thuật điều trị Lucentis có thể gây rối loạn thị lực tạm thời, có thể ảnh hưởng đến khả năng lái xe hoặc sử dụng máy móc. Bệnh nhân có những dấu hiệu này không được lái xe hoặc sử dụng máy móc cho đến khi các rối loạn thị lực tạm thời này giảm đi. – Tương tác thuốcChưa có nghiên cứu chính thức nào về tương tác được thực hiện. |
7. Thông tin thêm
– Bảo quản
Bảo quản trong tủ lạnh 2°C đến 8°C. Không làm đông lạnh.
– Quy cách đóng gói
Một hộp chứa 1 lọ 0,23 ml.
– Hạn sử dụng
36 tháng kể từ ngày sản xuất.
– Nhà sản xuất
Novartis Pharma Stein AG.








Đánh giá
Chưa có đánh giá nào.