| Mọi thông tin dưới đây đã được Dược sĩ biên soạn lại. Tuy nhiên, nội dung hoàn toàn giữ nguyên dựa trên tờ Hướng dẫn sử dụng, chỉ thay đổi về mặt hình thức. |
1. Thành phần
JARDIANCE 25mg viên nén bao phim chứa 25mg Empagliflozin.
Thành phần tá dược: Lactose monohydrate, Cellulose microcrystalline, Hydroxypropylcellulose, Natri croscarmellose, Silicia, colloidal dạng khan , Magnesium stearate, Opadry Yellow 02B38190 vừa đủ 1 viên.
2. Công dụng (Chỉ định)
Đái tháo đường tuýp 2
Kiểm soát đường huyết: Jardiance (Empagliflozin) được chỉ định trong điều trị đái tháo đường týp 2 ở người trưởng thành nhằm cải thiện khả năng kiểm soát đường huyết trong những trường hợp sau:
- Đơn trị liệu: Khi chế độ ăn kiêng và vận động không đủ để kiểm soát đường huyết một cách thích hợp ở những bệnh nhân không phù hợp dùng Metformin do không dung nạp.
- Điều trị phối hợp: Phối hợp với các thuốc hạ glucose khác bao gồm Insulin khi mà các thuốc này cùng với chế độ ăn kiêng và vận động không đủ để kiểm soát đường huyết một cách thích hợp.
Jardiance được chỉ định làm giảm nguy cơ tử vong tim mạch ở bệnh nhân trưởng thành đái tháo đường typ 2 và có sẵn bệnh lý tim mạch.
Suy tim
Jardiance được chỉ định làm giảm nguy cơ tử vong tim mạch và nhập viện do suy tim ở bệnh nhân trưởng thành suy tim.
Bệnh thận mạn tính
JARDIANCE được chỉ định để giảm nguy cơ suy giảm eGFR kéo dài, bệnh thận giai đoạn cuối, tử vong tim mạch và nhập viện ở bệnh nhân trưởng thành mắc bệnh thận mạn tính có nguy cơ tiến triển.
Giới hạn trong sử dụng: Không khuyến cáo sử dụng JARDIANCE để điều trị bệnh thận mạn tính ở bệnh nhân có bệnh thận đa nang hoặc bệnh nhân có yêu cầu hoặc có tiền sử gần đây sử dụng thuốc ức chế miễn dịch đường tiêm truyền hoặc dùng nhiều hơn 45mg prednisone hay tương đương trong điều trị bệnh lý thận. Dự kiến JARDIANCE sẽ không hiệu quả khi dùng trên đối tượng bệnh nhân này.
3. Cách dùng – Liều dùng
Đánh giá trước khi khởi trị với JARDIANCE
– Đánh giá chức năng thận trước khi khởi trị với JARDIANCE và khi có chỉ định lâm sàng. Không khuyến cáo sử dụng thuốc ở bệnh nhân có eGFR < 30 mL/phút/1,73 m2 để kiểm soát đường huyết
– Đánh giá tình trạng thể tích dịch. Trên bệnh nhân có giảm thể tích, cần điều chỉnh trước khi khởi trị với JARDIANCE.
Liều dùng
Bảng 1 thể hiện liều dùng khuyến cáo của JARDIANCE trên bệnh nhân trưởng thành.
Bảng 1 – Liều dùng khuyến cáo của JARDIANCE | |
Chỉ định | Liều khuyến cáo |
Giảm nguy cơ tử vong tim mạch và nhập viện ở bệnh nhân suy tim | 10 mg mỗi ngày uống buổi sáng, kèm hoặc không kèm thức ăn |
Giảm nguy cơ suy giảm eGFR kéo dài, bệnh thận giai đoạn cuối, tử vong tim mạch và nhập viện ở bệnh nhân trưởng thành mắc bệnh thận mạn tính có nguy cơ tiến triển | |
Giảm nguy cơ tử vong tim mạch ở bệnh nhân đái tháo đường týp 2 và có sẵn bệnh lý tim mạch | |
Kiểm soát đường huyết trên bệnh nhân đái tháo đường týp 2 | 10 mg mỗi ngày uống buổi sáng, kèm hoặc không kèm thức ăn. Để kiểm soát đường huyết tốt hơn, có thể tăng lên liều 25mg mỗi ngày ở bệnh nhân dung nạp liều 10mg mỗi ngày |
Các nhóm bệnh nhân đặc biệt
Bệnh nhân suy thận
Không khuyến cáo sử dụng thuốc ở bệnh nhân có eGFR < 30 mL/phút/1,73 m2 để kiểm soát đường huyết (Xem mục “Thận trọng khi dùng thuốc”).
Bệnh nhân suy gan
Không cần chỉnh liều ở bệnh nhân suy gan. Nồng độ empagliflozin tăng ở những bệnh nhân suy gan nặng. Kinh nghiệm điều trị trên bệnh nhân suy gan nặng còn hạn chế, do đó không khuyến cáo dùng thuốc cho nhóm bệnh nhân này (xem mục Đặc tính dược động học).
Bệnh nhân cao tuổi
Không cần chỉnh liều theo tuổi. Ở bệnh nhân từ 75 tuổi trở lên, nên xem xét đến khả năng tăng nguy cơ giảm thể tích (Xem mục “Thận trọng khi dùng thuốc”).
Bệnh nhi
Tính an toàn và hiệu quả của empagliflozin chưa được thiết lập trên trẻ em và thiếu niên. Không có dữ liệu.
Cách dùng
Có thể uống thuốc cùng hoặc không cùng thức ăn, nuốt cả viên với nước. Nếu một liều thuốc bị quên, cần uống lại ngay khi bệnh nhân nhớ. Không dùng liều gấp đôi trong cùng một ngày.
– Quá liều
Trong các nghiên cứu lâm sàng có đối chứng trên người khỏe mạnh, liều đơn lên tới 800mg Empagliflozin được dung nạp tốt.
Điều trị:
Trong các trường hợp quá liều, nên tiến hành các biện pháp điều trị hỗ trợ thích hợp với tình trạng lâm sàng của bệnh nhân. Chưa nghiên cứu loại bỏ Empagliflozin bằng lọc máu.
4. Chống chỉ định
- Quá mẫn với empagliflozin hoặc bất kỳ tá dược nào.
- Chống chỉ định sử dụng trong trường hợp bệnh nhân có bệnh lý di truyền hiếm gặp mà có thể không tương thích với một tá dược của thuốc (tham khảo mục “Thận trọng khi dùng thuốc”).
5. Tác dụng phụ
Tóm tắt đặc tính an toàn của thuốc
Đái tháo đường týp 2
Tổng số 15 582 bệnh nhân đái tháo đường typ 2 được điều trị trong các nghiên cứu lâm sàng để đánh giá tính an toàn của Empagliflozin, trong đó 10 004 bệnh nhân được điều trị với Empagliflozin đơn trị liệu hoặc kết hợp với Metformin, một thuốc Sulfonylurea, Pioglitazone, các thuốc ức chế DPP-4 hoặc Insulin.
Phân tích gộp này bao gồm nghiên cứu EMPA-REG OUTCOME® liên quan tới 7 020 bệnh nhân có nguy cơ cao về tim mạch (tuổi trung bình 63,1 tuổi, 9,3% bệnh nhân ít nhất là 75 tuổi, 28,5% là nữ) được điều trị bằng Jardiance 10mg/ngày (n=2345), Jardiance 25mg/ngày (n=2342),hoặc giả dược (n=2333) trong vòng 4,5 năm. Đặc tính chung về độ an toàn của Empagliflozin trong nghiên cứu này tương đương với đặc tính an toàn đã biết trước của thuốc.
Trong 6 thử nghiệm lâm sàng có đối chứng giả dược trong thời gian 18 đến 24 tuần, 3534 bệnh nhân đã tham gia, trong đó 1183 bệnh nhân được dùng giả dược và 2351 bệnh nhân được điều trị với Empagliflozin. Tỷ lệ chung của các biến cố bất lợi ở bệnh nhân điều trị bằng Empagliflozin tương tự như nhóm dùng giả dược. Tác dụng ngoại ý phổ biến nhất là hạ đường huyết khi sử dụng phối hợp với Sulfonylurea hoặc Insulin.
Suy tim
Các nghiên cứu EMPEROR bao gồm bệnh nhân suy tim với phân suất tống máu thất trái giảm (N=3726) hoặc với phân suất tống máu thất trái bảo tồn (N=5985) được điều trị bằng Empagliflozin 10mg hoặc giả dược. Khoảng một nửa số bệnh nhân bị đái tháo đường týp 2.
Tác dụng ngoại ý hay gặp nhất trong các nghiên cứu gộp EMPEROR-Reduced và EMPEROR Preserved là giảm thể tích (Empagliflozin 10mg: 11,4%; giả dược: 9,7%).
Bệnh thận mạn tính
Nghiên cứu EMPA-KIDNEY bao gồm các bệnh nhân bệnh thận mạn tính (N=6609) được điều trị bằng empagliflozin 10mg hoặc giả dược. Khoảng 44% bệnh nhân bị đái tháo đường týp 2. Không có tác dụng không mong muốn mới được ghi nhận trong nghiên cứu EMPA-KIDNEY.
Hồ sơ tổng thể về tính an toàn của JARDIANCE nhìn chung nhất quán giữa các chỉ định.
Bảng danh sách các tác dụng ngoại ý
Các tác dụng ngoại ý được phân loại theo hệ cơ quan và theo các thuật ngữ ưu tiên của MedDRA được báo cáo ở những bệnh nhân dùng Empagliflozin trong các thử nghiệm lâm sàng có đối chứng giả dược được trình bày trong bảng dưới đây (Bảng 2).
Các tác dụng ngoại ý được liệt kê theo tần suất tuyệt đối. Các tần suất được xác định rất phổ biến (≥ 1/10), phổ biến (≥1/100 đến <1/10), không phổ biến (≥1/1000 đến <1/100), hiếm gặp (≥1/10000 đến <1/1000), hoặc rất hiếm gặp (<1/10000) và không biết (không thể ước tính từ các dữ liệu sẵn có).
| Bảng 2 – Bảng liệt kê các tác dụng ngoại ý (MedDRA) được báo cáo trong những nghiên cứu đối chứng giả dược và từ kinh nghiệm hậu mãi. | ||||
Hệ cơ quan | Rất phổ biến | Phổ biến | Không phổ biến | Hiếm gặp |
Nhiễm khuẩn và nhiễm kí sinh trùng | Nấm âm đạo, viêm âm hộ và âm đạo, viêm quy đầu và các loại nhiễm khuẩn đường sinh dục khác Nhiễm khuẩn đường tiết niệu (bao gồm viêm thận – bể thận, hoặc nhiễm khuẩn huyết từ đường tiết niệu)a | Viêm cân mạc hoại tử vùng đáy chậu (hoại tử Fournier)* | ||
Rối loạn chuyển hoá và dinh dưỡng | Hạ đường huyết (khi sử dụng với sulphonylurea hoặc insulin)a | Khát | Nhiễm toan xê tôn* | |
Các rối loạn tiêu hóa | Táo bón | |||
Các rối loạn da và mô dưới da | Ngứa (nói chung) Các phản ứng dị ứng trên da (ví dụ: phát ban, mày đay) | Phù mạch | ||
Các rối loạn mạch | Giảm thể tícha | |||
Các rối loạn trên thận và đường niệu | Tăng bài niệua | Tiểu khó | ||
Cận lâm sàng | Tăng lipit huyết thanha | Tăng creatinin trong máu/ Giảm mức lọc cầu thậna Tăng hematocrita | ||
a Xem các mục nhỏ phía dưới để có thêm thông tin. * Xem mục Cảnh báo và thận trọng khi dùng thuốc. | ||||
Mô tả các tác dụng ngoại ý chọn lọc
Hạ đường huyết
Tần suất hạ đường huyết phụ thuộc vào điều trị nền trong các nghiên cứu tương ứng. Tần suất này là tương tự giữa empagliflozin và giả dược trong đơn trị liệu, phối hợp với metformin, phối hợp với pioglitazone dùng cùng hoặc không cùng với metformin, phối hợp với linagliptin và metformin, thêm vào điều trị chuẩn và trong phối hợp của empagliflozin với metformin trên bệnh nhân chưa dùng thuốc bao giờ so với bệnh nhân đã được điều trị trước đó với từng thuốc riêng rẽ.
Nhận thấy tần suất bệnh nhân bị hạ đường huyết tăng lên ở những bệnh nhân dùng empagliflozin phối hợp với metformin và sulfonylurea (empagliflozin 10 mg: 16,1 %, empagliflozin 25 mg 11,5%, giả dược 8,4%), phối hợp với insulin điều trị nền cùng hoặc không cùng với metformin và cùng hoặc không cùng với sulfonylurea (empagliflozin 10 mg: 19,5%; empagliflozin 25 mg: 28,4%; giả dược: 20,6% trong 18 tuần đầu điều trị khi không thể điều chỉnh liều insulin; ở thử nghiệm kéo dài 78 tuần, tần suất với empagliflozin 10 mg và empagliflozin 25 mg là 36,1%; và giả dược là 35,3%), thêm empagliflozin vào điều trị tiêm insulin nhiều lần trong ngày phối hợp hoặc không phối hợp với metformin (empagliflozin 10 mg: 39,8%; empagliflozin 25 mg: 41,3%; giả dược: 37,2% trong 18 tuần đầu điều trị khi không thể điều chỉnh liều insulin; ở thử nghiệm kéo dài 52 tuần, tần suất là empagliflozin 10 mg: 51,1%; empagliflozin 25 mg: 57,7%; giả dược: 58%).
Trong các nghiên cứu suy tim EMPEROR, đã ghi nhận hạ đường huyết khi dùng chung với sulphonylurea hoặc insulin với tần suất tương tự ở 2 nhóm (empagliflozin 10 mg: 6,5%, placebo: 6,7%).
Hạ đường huyết nghiêm trọng (biến cố phải cấp cứu)
Không quan sát thấy có sự tăng tần suất biến cố hạ đường huyết nghiêm trọng với Empagliflozin so với giả dược trong đơn trị liệu, kết hợp với Metformin và Sulfonylurea, kết hợp với Pioglitazone cùng hoặc không cùng với Metformin, bổ sung vào điều trị với Linagliptin và Metformin, thêm vào điều trị chuẩn và trong phối hợp của Empagliflozin với Metformin trên bệnh nhân chưa dùng thuốc bao giờ so với bệnh nhân đã được điều trị trước đó với từng thuốc riêng rẽ. Tần suất bệnh nhân bị hạ đường huyết nghiêm trọng được ghi nhận tăng lên ở những bệnh nhân dùng Empagliflozin phối hợp với Insulin điều trị nền cùng hoặc không cùng với Metformin và cùng hoặc không cùng với Sulfonylurea (Empagliflozin 10mg: 0%; Empagliflozin 25mg: 1,3%; giả dược: 0% trong 18 tuần đầu điều trị khi không thể điều chỉnh liều Insulin; ở thử nghiệm kéo dài 78 tuần, tần suất là Empagliflozin 10mg: 0%; Empagliflozin 25mg: 1,3%; giả dược: 0%), thêm Empagliflozin vào điều trị tiêm Insulin nhiều lần trong ngày phối hợp hoặc không phối hợp với Metformin (Empagliflozin 10mg: 1,6%; Empagliflozin 25mg: 0,5%; giả dược: 1,6% trong 18 tuần đầu điều trị khi không thể điều chỉnh liều Insulin và trong thử nghiệm kéo dài 52 tuần).
Trong các nghiên cứu suy tim EMPEROR, quan sát thấy hạ đường huyết nghiêm trọng với tần suất tương tự trên bệnh nhân đái tháo đường và nhóm giả dược khi dùng chung với Sulfonylurea hoặc Insulin (Empagliflozin 10mg: 2,2%, placebo: 1,9%).
Nấm âm đạo, viêm âm hộ và âm đạo, viêm quy đầu và các loại nhiễm khuẩn đường sinh dục khác
Nấm âm đạo, viêm âm hộ và âm đạo, viêm quy đầu và các loại nhiễm khuẩn đường sinh dục khác được báo cáo thường xuyên hơn ở nhóm dùng Empagliflozin (Empagliflozin 10mg: 4,0%, Empagliflozin 25mg: 3,9%) so với giả dược (1,0%). Các nhiễm khuẩn này được báo cáo thường xuyên hơn ở nhóm dùng Empagliflozin so với giả dược ở bệnh nhân nữ, và khác biệt ít về tần suất ở nhóm bệnh nhân nam. Các loại nhiễm khuẩn sinh dục có mức độ nhẹ đến trung bình.
Trong các nghiên cứu suy tim EMPEROR, tần suất các nhiễm khuẩn này phổ biến hơn trên bệnh nhân đái tháo đường (Empagliflozin 10mg: 2,3%, giả dược: 0,8%) so với bệnh nhân không bị đái tháo đường (Empagliflozin 10mg: 1,7%, giả dược: 0,7%) ở nhóm điều trị bằng Empagliflozin so với giả dược.
Tăng bài niệu
Tăng bài niệu (bao gồm các thuật ngữ được xác định từ trước như đi tiểu thường xuyên, tiểu quá nhiều, tiểu đêm) đã được quan sát với tần suất cao hơn ở những bệnh nhân điều trị với Empagliflozin (Empagliflozin 10mg: 3,5%; Empagliflozin 25mg: 3,3%) so với giả dược (1,4%). Hầu hết biến cố tăng bài niệu ở mức độ nhẹ hoặc trung bình. Tần suất tiểu đêm được báo cáo là tương tự ở nhóm dùng giả dược và Empagliflozin (<1%).
Trong các nghiên cứu suy tim EMPEROR, quan sát thấy tăng bài niệu xảy ra với tần suất tương tự giữa nhóm điều trị bằng Empagliflozin và nhóm giả dược (Empagliflozin 10mg: 0,9%, giả dược: 0,5%).
Nhiễm khuẩn đường niệu
Tần suất chung biến cố ngoại ý nhiễm khuẩn đường tiết niệu là tương tự ở những bệnh nhân điều trị với Empagliflozin 25mg và giả dược (7,0% và 7,2%), và cao hơn ở những bệnh nhân dùng Empagliflozin 10mg (8,8%). Tương tự như giả dược, nhiễm khuẩn đường tiết niệu được báo cáo thường xuyên hơn khi dùng Empagliflozin ở nhóm bệnh nhân có tiền sử viêm đường tiết niệu mạn tính hoặc tái phát. Mức độ viêm đường tiết niệu (nhẹ, trung bình, nặng) là tương tự giữa nhóm dùng Empagliflozin và giả dược. Các biến cố viêm đường tiết niệu được báo cáo thường xuyên hơn ở nhóm dùng Empagliflozin so với dùng giả dược trên bệnh nhân là nữ giới; không có sự khác biệt ở nhóm bệnh nhân nam giới.
Giảm thể tích
Nhìn chung tần suất giảm thể tích (bao gồm các thuật ngữ đã xác định từ trước giảm huyết áp (lưu động), giảm huyết áp tâm thu, mất nước, hạ huyết áp, giảm thể tích máu, hạ huyết áp tư thế đứng và ngất) là tương tự trên bệnh nhân điều trị với Empagliflozin so với nhóm dùng giả dược (Empagliflozin 10mg: 0,6%, Empagliflozin 25mg: 0,4%) và giả dược (0,3%). Tần suất giảm thể tích tăng trên bệnh nhân từ 75 tuổi trở lên điều trị bằng Empagliflozin 10mg (2,3%) hoặc Empagliflozin 25mg (4,3%) so với giả dược (2,1%).
Tăng creatinin máu/ Giảm mức lọc cầu thận
Tần suất chung tăng creatinin trong máu và giảm mức lọc cầu thận là tương tự giữa Empagliflozin và giả dược (tăng creatinin trong máu: Empagliflozin 10mg 0,6%, Empagliflozin 25mg 0,1%, giả dược 0,5%; giảm mức lọc cầu thận: Empagliflozin 10mg 0,1%, Empagliflozin 25mg 0%, giả dược 0,3%).
Trong một nghiên cứu mù đôi có đối chứng với giả dược trong 76 tuần, quan sát thấy creatinine máu bắt đầu tăng thoáng qua (thay đổi trung bình so với giá trị trung bình ban đầu sau 12 tuần: Empagliflozin 10mg 0,02mg/dL, Empagliflozin 25mg 0,01mg/dL) và mức lọc cầu thận bắt đầu giảm thoáng qua (thay đổi trung bình so với giá trị trung bình ban đầu sau 12 tuần: Empagliflozin 10mg -1,34/mL/min/1,73m2, Empagliflozin 25mg -1,37/mL/min/1,73m2). Những thay đổi này nhìn chung phục hồi được trong quá trình điều trị và sau khi ngừng dùng thuốc.
Tăng lipid huyết thanh
Phần trăm tăng trung bình so với ban đầu ở nhóm Empagliflozin 10mg và 25mg so với giả dược lần lượt là tổng cholesterol 4,9% và 5,7% so với 3,5%; HDL-cholesterol 3,3% và 3,6% so với 0,4%; LDL-cholesterol 9,5% và 10,0% so với 7,5%; triglycerid 9,2% và 9,9% so với 10,5%.
Tăng hematocrit
Thay đổi trung bình so với hematocrit ban đầu là 3,4% và 3,6% lần lượt với Empagliflozin 10mg và 25mg, so với 0,1% với placebo. Trong nghiên cứu EMPA-REG Outcome, các giá trị hematocrit quay trở lại giá trị ban đầu sau khi dừng điều trị 30 ngày.
Thông báo ngay cho bác sỹ hoặc dược sỹ những phản ứng có hại gặp phải khi sử dụng thuốc
6. Lưu ý |
– Cảnh báo và thận trọng khi dùng thuốcNhiễm toan xê tôn Các trường hợp nhiễm toan xê tôn, bao gồm các trường hợp đe dọa đến tính mạng và tử vong, đã được báo cáo ở bệnh nhân đái tháo đường được điều trị bằng các thuốc ức chế SGLT2 bao gồm empagliflozin. Trong một vài trường hợp, tình trạng này xuất hiện một cách không điển hình, chỉ với sự tăng trung bình glucose trong máu, dưới 14 mmol/L (250mg/dL). Không biết được liệu nhiễm toan xê tôn có xảy ra nhiều hơn với liều empagliflozin cao hơn hay không. Mặc dù nhiễm toan xê tôn dường như ít xảy ra trên bệnh nhân không bị đái tháo đường, đã có báo cáo về các trường hợp nhiễm toan xê tôn ở những bệnh nhân này. Phải xem xét đến nguy cơ nhiễm toan xê tôn khi thấy các triệu chứng không điển hình như nôn, buồn nôn, chán ăn, đau bụng, khát nhiều, khó thở, lẫn lộn, mệt mỏi bất thường hay buồn ngủ. Nếu các triệu chứng trên xuất hiện, phải đánh giá toan xê tôn cho bệnh nhân ngay lập tức, bất kể mức đường huyết. Nếu nghi ngờ hoặc chẩn đoán bệnh nhân có nhiễm toan xê tôn, nên ngừng dùng empagflozin ngay lập tức. Nên tạm ngừng điều trị ở những bệnh nhân nhập viện để làm các phẫu thuật lớn hoặc bị các căn bệnh nặng cấp tính. Khuyến cáo theo dõi mức xê tôn ở những bệnh nhân này. Đo nồng độ xê tôn trong máu được ưu tiên hơn trong nước tiểu. Có thể bắt đầu sử dụng lại empagliflozin khi nồng độ xê tôn ở mức bình thường và tình trạng bệnh nhân ổn định. Trước khi điều trị với empagliflozin, nên xem xét đến các yếu tố trong bệnh sử của bệnh nhân có thể dẫn tới toan xê tôn. Không khuyến cáo sử dụng lại các thuốc ức chế SGLT2 ở những bệnh nhân trước đó đã bị nhiễm toan xê tôn trong khi đang dùng thuốc ức chế SGLT2, trừ khi xác định rõ ràng do nguyên nhân khác và đã giải quyết được nguyên nhân đó. Không nên sử dụng JARDIANCE để điều trị bệnh nhân đái tháo đường týp 1. Dữ liệu từ một nghiên cứu lâm sàng trên bệnh nhân đái tháo đường týp 1 cho thấy có sự gia tăng nhiễm toan xê tôn xảy ra với tần suất phổ biến trên nhóm bệnh nhân sử dụng empagliflozin 10mg hoặc 25mg thêm với insulin so với nhóm giả dược. Viêm cân mạc hoại tử vùng đáy chậu (hoại tử Fournier) Đã có báo cáo về các trường hợp viêm cân mạc hoại tử vùng đáy chậu (hay còn gọi là hoại tử Fournier), một dạng nhiễm khuẩn hoại tử hiếm gặp nhưng nghiêm trọng và đe dọa đến tính mạng, trên bệnh nhân đái tháo đường nam và nữ đang điều trị bằng các thuốc ức chế SGLT2 bao gồm Empagliflozin. Hậu quả nghiêm trọng bao gồm nhập viện, đa phẫu và tử vong. Bệnh nhân đang được điều trị bằng Jardiance nếu xuất hiện đau hoặc tấy, đỏ, sưng bộ phận sinh dục hoặc vùng đáy chậu, sốt, mệt mỏi thì cần được đánh giá bệnh viêm cân mạc hoại tử. Nếu nghi ngờ mắc bệnh, cần ngừng thuốc Jardiance và nhanh chóng điều trị (bao gồm dùng kháng sinh phổ rộng và phẫu thuật cắt bỏ phần mô bị nhiễm trùng nếu cần thiết). Suy thận Hiệu quả và tính an toàn của Jardiance trong kiểm soát đường huyết được đánh giá trong một nghiên cứu trên bệnh nhân đái tháo đường týp 2 có suy thận mức độ vừa và nhẹ (eGFR từ 30 đến < 90 mL/phút/1,73m2). Trong nghiên cứu này, 195 bệnh nhân dùng Jardiance có eGFR trong khoảng 60–90 mL/phút/1,73m2, 91 bệnh nhân dùng Jardiance có eGFR trong khoảng 45-60 mL/phút/1,73m2, và 97 bệnh nhân dùng Jardiance có eGFR trong khoảng 30-45 mL/phút/1,73m2. Lợi ích trên việc giảm đường huyết của Jardiance 25mg giảm trên bệnh nhân có chức năng thận suy giảm. Các nguy cơ suy thận, giảm thể tích, tác dụng không mong muốn và các tác dụng không mong muốn liên quan đến nhiễm khuẩn đường tiết niệu tăng khi chức năng thận suy giảm. Không khuyến cáo sử dụng Jardiance để kiểm soát đường huyết trên bệnh nhân không có sẵn bệnh lý tim mạch hoặc các yếu tố nguy cơ tim mạch cao khi eGFR < 30 mL/phút/1,73m2. JARDIANCE đã được đánh giá trên 7020 bệnh nhân trưởng thành đái tháo đường týp 2 và có sẵn bệnh lý tim mạch (eGFR ≥ 30 mL/phút/1,73m2) trong nghiên cứu EMPA-REG OUTCOME, trên tổng số 9718 bệnh nhân suy tim (eGFR ≥ 20 mL/phút/1,73m2) trong nghiên cứu EMPEROR-Reduced và EMPEROR-Preserved, và trên 6609 bệnh nhân trưởng thành suy thận mạn (eGFR từ 20-90 mL/phút/1,73m2) trong nghiên cứu EMPA-KIDNEY. Hồ sơ về tính an toàn của các phân nhóm theo mức eGFR trong các nghiên cứu này nhất quán với hồ sơ an toàn đã biết. Các nghiên cứu về hiệu quả và tính an toàn của JARDIANCE không thu nhận các bệnh nhân có eGFR < 20 mL/phút/1,73 m2 hoặc lọc thận. Khi đã được thu nhận vào nghiên cứu, bệnh nhân trưởng thành trong các nghiên cứu EMPA-REG OUTCOME, EMPEROR-Reduced, EMPEROR-Preserved và EMPA-KIDNEY không yêu cầu ngưng điều trị vì lý do eGFR giảm xuống dưới 20 mL/phút/1,73 m2 hoặc bắt đầu phải lọc thận. Theo dõi chức năng thận Khuyến cáo đánh giá chức năng thận trước khi điều trị với Empagliflozin như sau: – Trước khi khởi đầu điều trị với Empagliflozin và định kỳ kiểm tra trong quá trình điều trị, tức là tối thiểu kiểm tra hàng năm. – Trước khi bắt đầu điều trị phối hợp với bất kỳ thuốc nào có thể có ảnh hưởng xấu đến chức năng thận. Tổn thương gan Các trường hợp tổn thương gan đã được báo cáo trong các thử nghiệm lâm sàng. Chưa thiết lập mối quan hệ nhân quả giữa Empagliflozin và việc tổn thương gan. Bệnh nhân cao tuổi Tác dụng của Empagliflozin lên sự thải trừ glucose qua đường niệu liên quan đến các thuốc lợi niệu thẩm thấu, những thuốc có thể ảnh hưởng đến tình trạng đủ nước trong cơ thể. Bệnh nhân từ 75 tuổi trở lên có thể có tăng nguy cơ giảm thể tích. Số lượng bệnh nhân ở nhóm này điều trị với Empagliflozin gặp tác dụng phụ cao hơn so với nhóm dùng giả dược. Sử dụng thuốc ở bệnh nhân có nguy cơ giảm thể tích Dựa vào cơ chế tác dụng của các chất ức chế SGLT-2, dùng thuốc lợi tiểu thẩm thấu đồng thời với thải đường qua nước tiểu có thể dẫn đến giảm huyết áp vừa phải. Do đó, nên thận trọng khi thực hành kê toa ở những bệnh nhân mà sự giảm huyết áp gây ra bởi Empagliflozin có thể tạo ra một nguy cơ, ví dụ những bệnh nhân đã biết mắc bệnh tim mạch, bệnh nhân đang điều trị tăng huyết áp có tiền sử hạ huyết áp hoặc bệnh nhân tuổi từ 75 trở lên. Trong những trường hợp có thể dẫn đến mất dịch (ví dụ bệnh dạ dày ruột), khuyến cáo kiểm soát chặt chẽ tình trạng thể tích (ví dụ khám sức khỏe, đo huyết áp, các xét nghiệm cận lâm sàng kể cả hematocrit) và điện giải ở bệnh nhân đang điều trị với Empagliflozin. Nên cân nhắc ngưng tạm thời điều trị với Jardiance cho đến khi hết tình trạng mất dịch. Nhiễm khuẩn đường tiết niệu có biến chứng Đã có báo cáo về các trường hợp nhiễm khuẩn đường tiết niệu có biến chứng bao gồm viêm thận – bể thận và nhiễm khuẩn huyết từ đường tiết niệu ở những bệnh nhân điều trị với Empagliflozin. Cân nhắc ngưng Jardiance tạm thời ở những bệnh nhân bị nhiễm khuẩn đường tiết niệu có biến chứng. Các xét nghiệm nước tiểu Do cơ chế tác dụng của thuốc, bệnh nhân đang dùng Jardiance sẽ xét nghiệm dương tính với glucose trong nước tiểu. Lactose Viên nén có chứa lactose. Không nên dùng thuốc này ở những bệnh nhân có bệnh lý di truyền hiếm gặp bất dung nạp galactose, thiếu hụt Lapp lactase hoặc hấp thu kém glucose-galactose. – Phụ nữ có thai và cho con búThai kỳ Có ít dữ liệu về việc sử dụng Jardiance trên phụ nữ mang thai. Các nghiên cứu phi lâm sàng không chỉ ra ảnh hưởng gây hại trực tiếp hoặc gián tiếp tới độc tính trên khả năng sinh sản. Để thận trọng, tốt hơn nên tránh sử dụng Jardiance trong thai kỳ trừ khi việc sử dụng là thật sự cần thiết. Cho con bú Không có dữ liệu trên người về bài tiết Empagliflozin vào sữa mẹ. Dữ liệu phi lâm sàng trên động vật cho thấy có sự bài tiết của Empagliflozin vào sữa động vật mẹ. Không thể loại trừ nguy cơ đối với trẻ sơ sinh/nhũ nhi. Khuyến cáo ngừng cho con bú khi điều trị với Jardiance. Khả năng sinh sản Chưa tiến hành nghiên cứu về ảnh hưởng của Jardiance lên khả năng sinh sản ở người. Các nghiên cứu phi lâm sàng trên động vật không cho thấy ảnh hưởng gây hại trực tiếp hoặc gián tiếp trên khả năng sinh sản. – Khả năng lái xe và vận hành máy mócJardiance ít có ảnh hưởng trên khả năng lái xe và vận hành máy móc. Nên khuyên bệnh nhân thận trọng để tránh hạ đường huyết trong khi lái xe và vận hành máy móc, đặc biệt khi sử dụng Jardiance phối hợp với Sulfonylurea và/hoặc Insulin. – Tương tác thuốcTương tác dược lực học Thuốc lợi tiểu Empagliflozin có thể bổ sung tác dụng lợi tiểu của thiazide và các thuốc lợi tiểu quai và có thể làm tăng nguy cơ mất nước và hạ huyết áp. Insulin và các thuốc kích thích bài tiết Insulin Insulin và các thuốc kích thích bài tiết Insulin như Sulfonylurea có thể làm tăng nguy cơ hạ đường huyết. Do đó, khi dùng phối hợp với Empagliflozin có thể phải dùng Insulin và các thuốc kích thích bài tiết Insulin với liều thấp hơn để giảm nguy cơ hạ đường huyết (xem Liều lượng và Cách dùng và Tác dụng không mong muốn) Can thiệp bằng thử nghiệm 1,5-anhydroglucitol (1,5-AG) Không khuyến cáo việc giám sát kiểm soát đường huyết bằng thử nghiệm 1,5-anhydroglucitol (1,5- AG) vì phương pháp đo mức 1,5-AG để đánh giá sự kiểm soát đường huyết trên bệnh nhân đang sử dụng thuốc ức chế SGLT2 là không đáng tin cậy. Sử dụng các phương pháp khác để giám sát việc kiểm soát đường huyết. Tương tác dược động học Lithium Sử dụng lithium cùng với các thuốc ức chế SGLT2, bao gồm empagliflozin, có thể làm giảm nồng độ lithium trong máu thông qua việc tăng thải lithium qua thận. Vì vậy, nên theo dõi nồng độ lithium huyết thanh thường xuyên hơn khi bắt đầu điều trị với empagliflozin hoặc sau khi thay đổi liều. Vui lòng nhắc nhở bệnh nhân báo với bác sỹ kê đơn lithium để theo dõi nồng độ lithium trong huyết thanh. Đánh giá tương tác thuốc in vitro Empagliflozin không ức chế, bất hoạt hoặc kích thích đến các đồng dạng CYP450. Dữ liệu in vitro cho thấy đường chuyển hoá chính của empagliflozin ở người là glucuronide hoá bởi các uridine 5′-diphospho-glucuronosyltransferase UGT2B7, UGT1A3, UGT1A8 và UGT1A9. Empagliflozin là một cơ chất của P-glycoprotein (P-gp) và protein đề kháng ung thư vú (BCRP), nhưng nó không ức chế các chất vận chuyển xuất bào này ở những liều điều trị. Dựa vào những nghiên cứu in vitro, empagliflozin được cho là không có khả năng gây tương tác với các thuốc là cơ chất của P-gp. Empagliflozin là một cơ chất của các chất vận chuyển hấp thu ở người OAT3, OATP1B1 và OATP1B3, nhưng không của OAT1 và OCT2. Empagliflozin không ức chế bất kỳ chất vận chuyển hấp thu trên người ở nồng độ huyết tương có liên quan trên lâm sàng, do đó tương tác thuốc – thuốc với cơ chất của những chất vận chuyển hấp thu này được xem như không có. Đánh giá tương tác thuốc in vivo Không có các tương tác dược động học nào có ý nghĩa lâm sàng được ghi nhận khi dùng Empagliflozin đồng thời với các thuốc thông thường khác. Dựa vào kết quả của những nghiên cứu dược động học, khuyến cáo không phải chỉnh liều Jardiance khi sử dụng kết hợp với các thuốc kê đơn thông dụng khác. Dược động học của empagliflozin trên người tình nguyện khoẻ mạnh là tương tự khi sử dụng cùng hay không cùng với metformin, glimepiride, pioglitazone, sitagliptin, linagliptin, warfarin, verapamil, ramipril, simvastatin ở người tình nguyện khoẻ mạnh và khi sử dụng cùng hay không cùng với torasemide và hydrochlorothiazide ở bệnh nhân đái tháo đường týp 2. Đã quan sát thấy nồng độ toàn phần (AUC) của empagliflozin tăng lên sau khi sử dụng đồng thời với gemfibrozil (59%), rifampicin (35%), hoặc probenecid (53%). Những thay đổi này không được xem là có ý nghĩa lâm sàng. Empagliflozin không có ảnh hưởng liên quan lâm sàng trên dược động học của metformin, Tương kỵ của thuốc Không áp dụng. |
7. Dược lý
– Dược động học (Tác động của cơ thể với thuốc)
Hấp thu
Dược động học của Empagliflozin đã được nghiên cứu rộng rãi ở người tình nguyện khỏe mạnh và bệnh nhân đái tháo đường typ 2. Sau khi uống, Empagliflozin nhanh chóng được hấp thu với nồng độ đỉnh trong huyết tương đạt được trung bình tmax 1,5 giờ sau khi dùng thuốc. Sau đó, nồng độ huyết tương giảm theo 2 pha với một pha phân bố nhanh và một pha kết thúc tương đối chậm. AUC huyết tương ở trạng thái ổn định trung bình là 4740 nmol.giờ/L và Cmax là 687 nmol/L khi dùng Empagliflozin liều 25mg một lần mỗi ngày (qd). Nồng độ toàn thân của Empagliflozin tăng tỉ lệ với liều. Các thông số dược động học ở liều đơn và ở trạng thái ổn định của Empagliflozin là tương tự cho thấy dược động học tuyến tính theo thời gian. Không có khác biệt liên quan lâm sàng giữa dược động học của Empagliflozin trên người tình nguyện khỏe mạnh và bệnh nhân đái tháo đường typ 2.
Sử dụng 25mg Empagliflozin sau khi dùng bữa ăn giàu chất béo và nhiều calo dẫn tới nồng độ thuốc thấp hơn một chút; AUC giảm khoảng 16% và Cmax giảm khoảng 36% so với trạng thái đói. Ảnh hưởng của thức ăn trên dược động học Empagliflozin đã quan sát thấy được xem là không có liên quan trên lâm sàng và Empagliflozin có thể được dùng cùng hoặc không cùng với thức ăn.
Phân bố
Dựa vào phân tích dược động học theo dân số, thể tích phân bố ở trạng thái ổn định biểu kiến được ước tính là 73,8 L. Sau khi dùng dạng uống dung dịch [14C]-Empagliflozin ở người tình nguyện khoẻ mạnh, tỉ lệ phân bố trong hồng cầu xấp xỉ 36,8% và gắn kết protein huyết tương là 86,2%.
Chuyển hoá
Không có chất chuyển hoá chính nào của Empagliflozin được tìm thấy trong huyết tương người và chất chuyển hoá chủ yếu là 3 chất liên hợp glucuronide (2-O-, 3-O-, và 6-O- glucuronide). Nồng độ trong tuần hoàn của mỗi chất chuyển hoá là ít hơn 10% tổng số các chất liên quan đến thuốc. Các nghiên cứu in vitro cho thấy đường chuyển hoá chính của Empagliflozin ở người là glucuronid hóa bởi các uridine 5′-diphospho-glucuronosyltransferase UGT2B7, UGT1A3, UGT1A8, và UGT1A9.
Thải trừ
Dựa vào phân tích dược động học theo nhóm dân số, nửa đời thải trừ biểu kiến của empagliflozin ước tính khoảng 12,4 giờ và độ thanh thải đường uống biểu kiến là 10,6 L/giờ. Biến thiên giữa các cá thể và thặng dư của độ thanh thải empagliflozin đường uống tương ứng là 39,1% và 35,8%. Với liều dùng 1 lần trong ngày, nồng độ huyết tương ở trạng thái ổn định của empagliflozin đạt được sau khi dùng liều thứ năm. Cũng giống như nửa đời thải trừ, biến thiên về tích luỹ thuốc, biểu hiện bằng AUC, lên đến 22% quan sát thấy khi đạt trạng thái ổn định. Sau khi dùng dạng uống dung dịch [14C]- empagliflozin trên người tình nguyện khoẻ mạnh, khoảng 95,6% thuốc liên quan có hoạt tính phóng xạ được tìm thấy trong phân (41,2%) hoặc nước tiểu (54,4%). Phần lớn thuốc có hoạt tính phóng xạ được tìm thấy trong phân là không đổi so với thuốc ban đầu và xấp xỉ một nửa thuốc có hoạt tính phóng xạ được bài tiết trong nước tiểu dưới dạng không đổi so với ban đầu.
Nhóm bệnh nhân đặc biệt
Suy chức năng thận
Ở những bệnh nhân suy chức năng thận nhẹ (eGFR: 60 – <90 mL/phút/1,73m2), trung bình (eGFR: 30 – <60 mL/phút/1,73m2), nặng (eGFR: <30 mL/phút/1,73m2) và những bệnh nhân suy thận giai đoạn cuối, AUC của Empagliflozin tăng khoảng 18%, 20%, 66% và 48% tương ứng so với các bệnh nhân có chức năng thận bình thường. Nồng độ đỉnh trong huyết tương của Empagliflozin là tương tự ở những bệnh nhân suy thận trung bình và suy thận giai đoạn cuối so với những bệnh nhân có chức năng thận bình thường. Nồng độ đỉnh trong huyết tương của Empagliflozin nhìn chung cao hơn 20% ở những đối tượng suy thận nhẹ và nặng so với những bệnh nhân có chức năng thận bình thường. Cùng với nghiên cứu pha I, phân tích dược động học theo nhóm dân số cho thấy độ thanh thải đường uống biểu kiến của Empagliflozin giảm theo eGFR dẫn đến tăng nồng độ thuốc. Dựa trên dữ liệu dược động học, khuyến cáo không cần chỉnh liều trên bệnh nhân suy chức năng thận.
Suy chức năng gan
Ở những đối tượng suy chức năng gan nhẹ, trung bình và nặng theo phân loại Child-Pugh, AUC của Empagliflozin tăng khoảng 23%, 47% và 75% và Cmax tăng khoảng 4%, 23% và 48% so với các đối tượng có chức năng gan bình thường.
Chỉ số khối cơ thể
Không cần thiết điều chỉnh liều theo chỉ số khối cơ thể BMI. Dựa theo phân tích dược động học trên nhóm dân số, chỉ số khối cơ thể không ảnh hưởng liên quan lâm sàng đến dược động học của Empagliflozin.
Giới tính
Không cần thiết điều chỉnh liều theo giới tính. Dựa vào phân tích dược động học theo nhóm dân số, giới tính không ảnh hưởng liên quan lâm sàng đến dược động học của Empagliflozin.
Chủng tộc
Không cần thiết điều chỉnh liều theo chủng tộc. Dựa vào phân tích dược động học theo nhóm dân số, AUC ở người Châu Á có BMI 25 kg/m2 cao hơn 13,5% so với bệnh nhân không phải là người Châu Á có cùng BMI 25 kg/m2.
Người cao tuổi
Tuổi tác không ảnh hưởng có ý nghĩa lâm sàng trên dược động học của Empagliflozin dựa vào phân tích dược động học trên nhóm dân số.
Trẻ em
Chưa tiến hành các nghiên cứu xác định dược động học của Empagliflozin ở bệnh nhân nhi.
– Dược lực học (Tác động của thuốc lên cơ thể)
Nhóm điều trị dược lý: chất ức chế SGLT2; mã ATC: A10BK03.
Cơ chế tác động
Empagliflozin là một chất ức chế SGLT2 cạnh tranh, chọn lọc, mạnh và thuận nghịch với IC50 là 1,3 nM. Empagliflozin có tính chọn lọc cao hơn 5000 lần trên SGLT1 của người (IC50 là 6278 nM), SGLT1 chịu trách nhiệm cho quá trình hấp thu đường ở ruột. Hơn nữa, tính chọn lọc cao có thể hướng tới các chất vận chuyển đường khác (GLUTs) chịu trách nhiệm cho việc cân bằng đường ở các mô khác nhau.
SGLT-2 có mặt nhiều ở thận trọng khi ở các mô khác là không có hoặc rất ít. SGLT-2 chịu trách nhiệm như là một chất vận chuyển chiếm ưu thế cho quá trình tái hấp thu đường từ màng lọc cầu thận trở lại tuần hoàn. Ở những bệnh nhân đái tháo đường týp 2 và bệnh nhân có đường huyết cao, một lượng đường lớn hơn được lọc và tái hấp thu.
Empagliflozin cải thiện kiểm soát đường huyết ở những bệnh nhân đái tháo đường týp 2 theo cơ chế giảm tái hấp thu đường ở thận. Lượng đường được loại bỏ qua thận theo cơ chế đường thải qua nước tiểu phụ thuộc vào nồng độ đường và GFR. Thông qua việc ức chế SGLT-2 ở những bệnh nhân đái tháo đường týp 2 và tăng đường huyết, lượng đường thừa sẽ được bài tiết qua nước tiểu.
Ở những bệnh nhân đái tháo đường týp 2, bài tiết đường qua nước tiểu ngay lập tức tăng lên sau khi dùng liều đầu tiên empagliflozin và tiếp tục tăng sau hơn 24 giờ cách liều. Tăng bài tiết đường qua đường niệu được duy trì tại thời điểm cuối tuần thứ 4 của giai đoạn điều trị, trung bình khoảng 78 g/ngày khi dùng empagliflozin 25 mg một lần mỗi ngày. Tăng thải trừ đường niệu ngay lập tức làm giảm nồng độ đường trong huyết tương ở những bệnh nhân đái tháo đường týp 2.
Empagliflozin (10 mg và 25 mg) cải thiện nồng độ đường huyết khi đói và sau khi ăn.
Cơ chế tác dụng của empagliflozin không phụ thuộc vào chức năng tế bào beta và con đường điều hoà đường huyết của insulin, điều này góp phần làm giảm nguy cơ hạ đường huyết. Cải thiện các chất đánh dấu đại diện cho chức năng tế bào beta đã được ghi nhận bao gồm HOMA- β (Mô hình Đánh giá cân bằng nội môi tế bào β) và tỉ lệ proinsulin/ insulin. Thêm vào đó bài tiết đường niệu cũng làm mất calo, liên quan với giảm béo và giảm cân.
Đã quan sát thấy tình trạng tăng đường niệu khi dùng empagliflozin đi kèm với lợi tiểu nhẹ, có thể góp phần làm giảm huyết áp trung bình và ổn định.
Empagliflozin cũng làm giảm tái hấp thu natri và tăng vận chuyển natri đến ống lượn xa. Điều này có thể ảnh hưởng đến một số chức năng sinh lý, bao gồm, nhưng không giới hạn, làm tăng điều hòa ngược ống cầu thận và giảm áp lực nội cầu, giảm cả tiền gánh và hậu gánh của tim, điều hòa hoạt động giao cảm và giảm áp lực thành thất trái do có bằng chứng cho thấy các chỉ số NT-proBNP thấp hơn và điều này có thể đem lại những tác động có lợi trong tái cấu trúc tim, áp suất làm đầy và chức năng tâm trương cũng như bảo tồn cấu trúc và chức năng thận. Các hiệu quả khác như tăng hematocrit, giảm cân và giảm huyết áp có thể góp phần vào những lợi ích trên tim mạch và thận.
Thử nghiệm lâm sàng
Đái tháo đường týp 2
Tổng số 17331 bệnh nhân đái tháo đường typ 2 được đánh giá trong 15 nghiên cứu lâm sàng mù đôi, có đối chứng với giả dược và hoạt chất, trong đó 4603 bệnh nhân điều trị với Empagliflozin 10mg và 5567 dùng Empagliflozin 25mg. Sáu nghiên cứu có thời gian điều trị kéo dài 24 tuần; trong phần mở rộng của những nghiên cứu này và các nghiên cứu khác thì bệnh nhân được dùng Jardiance lên đến 102 tuần.
Điều trị với Empagliflozin (10mg và 25mg) trong đơn trị liệu và kết hợp với Metformin, Pioglitazone, Sulfonylurea, các chất ức chế DPP-4, và Insulin giúp cải thiện có ý nghĩa lâm sàng HbA1c, đường huyết lúc đói (FPG), cân nặng, huyết áp tâm thu và tâm trương (SBP và DBP). Dùng Empagliflozin 25mg giúp tỷ lệ bệnh nhân đạt được HbA1c mục tiêu dưới 7% cao hơn và số bệnh nhân cần điều trị cứu nguy do rối loạn đường huyết ít hơn so với Empagliflozin 10mg và giả dược. Đã thấy cải thiện HbA1c có ý nghĩa lâm sàng ở tất cả các phân nhóm về giới tính, chủng tộc, vùng địa lý, thời gian khi được chẩn đoán đái tháo đường typ 2, chỉ số khối cơ thể, đề kháng Insulin dựa vào Mô hình Đánh giá HOMA-IR và chức năng tế bào beta dựa vào HOMA- β. HbA1c cao hơn ở thời điểm ban đầu sẽ đi kèm với HbA1c giảm nhiều hơn. Đã quan sát thấy giảm HbA1c có ý nghĩa trên lâm sàng ở những bệnh nhân có eGFR > 30 mL/phút/1,73m2.
Đã quan sát thấy hiệu quả của Jardiance giảm ở những bệnh nhân từ 75 tuổi trở lên.
– Empagliflozin đơn trị liệu
Tính an toàn và hiệu quả của Empagliflozin (10mg và 25mg) trong đơn trị liệu đã được đánh giá trong một nghiên cứu mù đôi kéo dài 24 tuần, có đối chứng với giả dược và đối chứng với hoạt chất trên những bệnh nhân điều trị lần đầu.
Điều trị với Jardiance dẫn đến giảm đáng kể có ý nghĩa thống kê chỉ số HbA1c, trọng lượng cơ thể và huyết áp tâm thu (SBP) so với giả dược (Bảng 3) và giảm nồng độ đường trong huyết tương lúc đói (FPG) có ý nghĩa lâm sàng. Đã quan sát thấy một số bệnh nhân giảm huyết áp tâm trương (DBP) so với giả dược nhưng không đạt tới mức giảm có ý nghĩa thống kê (giảm 1,0mmHg đối với Empagliflozin 10mg, giảm 1,9mmHg đối với Empagliflozin 25mg, giảm 0,5 đối với giả dược, và tăng 0,7mmHg đối với sitagliptin).
Trong một phân tích đã xác định trước bệnh nhân (N=201) với HbA1c ban đầu từ ≥ 8,5% đến ≤ 10%, Empagliflozin làm giảm HbA1c so với thời điểm ban đầu, giảm 1,44% ở nhóm dùng Empagliflozin 10mg, giảm 1,43% ở nhóm dùng Empagliflozin 25mg, tăng 0,01% ở nhóm dùng giả dược, và giảm 1,04% ở nhóm dùng sitagliptin.
Trong phần mở rộng mù đôi có đối chứng với giả dược của nghiên cứu này, giảm HbA1c (thay đổi từ thời điểm ban đầu giảm 0,65 khi dùng Empagliflozin 10mg, giảm 0,76% khi dùng Empagliflozin 25mg, tăng 0,13% khi dùng giả dược, và giảm 0,53% khi dùng sitagliptin), trọng lượng cơ thể (thay đổi so với thời điểm ban đầu, giảm 2,24 kg khi dùng Empagliflozin 10mg, giảm 2,45 kg khi dùng Empagliflozin 25mg, giảm 0,43 kg khi dùng giả dược và tăng 0,10 kg khi dùng sitagliptin) và huyết áp (huyết áp tâm thu SBP: thay đổi so với thời điểm ban đầu, giảm 4,1mmHg khi dùng Empagliflozin 10mg, giảm 4,2mmHg khi dùng Empagliflozin 25mg, giảm 0,7mmHg khi dùng giả dược và giảm 0,3mmHg khi dùng sitagliptin; huyết áp tâm trương DBP: thay đổi so với thời điểm ban đầu, giảm 1,6mmHg khi dùng Empagliflozin 10mg, giảm 1,6mmHg khi dùng Empagliflozin 25mg, giảm 0,6mmHg khi dùng giả dược và giảm 0,1mmHg khi dùng sitagliptin) được duy trì cho tới tuần điều trị thứ 76.
Điều trị với Jardiance hàng ngày cải thiện đáng kể chất đánh dấu chức năng của tế bào beta HOMA-B.
| Bảng 3 – Kết quả nghiên cứu kéo dài 24 tuần (LOCF)1 có đối chứng với giả dược dùng Jardiance đơn trị liệu (Bộ phân tích đầy đủ) | ||||
Jardiance đơn trị liệu | Giả dược | Empagliflozin 10mg | Empagliflozin 25mg | Sitagliptin 100mg |
N | 228 | 224 | 224 | 223 |
HbA1c (%) |
|
|
|
|
Giá trị ban đầu (trung bình) | 7,91 | 7,87 | 7,86 | 7,85 |
Thay đổi so với ban đầu2 | 0,08 | -0,66 | -0,78 | -0,66 |
Khác biệt so với giả dược2 (KTC 97,5%) | -0,74* (-0,90, -0,57) | -0,85* (-1,01, -0,69) | -0,73 (-0,88, -0,59)3 | |
N | 208 | 204 | 202 | 200 |
Bệnh nhân (%) đạt được HbA1c <7% với giá trị HbA1c ban đầu ≥7%4 | 12,0 | 35,3 | 43,6 | 37,5 |
N | 226 | 223 | 223 | 223 |
FPG (mg/dl) [mmol/l]4 | ||||
Giá trị ban đầu (trung bình) | 154,7 [8,59] | 152,8 [8,48] | 152,6 [8,47] | 147,1 [8,17] |
Thay đổi so với ban đầu2 | 11,8 [0,65] | -19,4 [-1,08] | 24,5 [-1,36] | -6,9 [-0,38] |
Khác biệt so với giả dược2 (KTC 95%) | -31,2 (-36,6, -25,8) [-1,73 (-2,03, -1,43)] | -36,2 (-41,7, -30,8) [-2,01 (-2,31, -1,71)] | -18,7 (-24,2, -13,2) [-1,04 (-1,34, -0,73)] | |
N | 228 | 224 | 224 | 223 |
Trọng lượng cơ thể (kg) | ||||
Giá trị ban đầu (trung bình) | 78,23 | 78,35 | 77,80 | 79,31 |
Thay đổi so với ban đầu2 | -0,33 | -2,26 | -2,48 | 0,18 |
Khác biệt so với giả dược2 (KTC 97,5%) | -1,93* (-2,48, -1,38) | -2,15* (-2,70,-1,60) | 0,52 (-0,04, 1,00)4 | |
N | 228 | 224 | 224 | 223 |
Bệnh nhân (%) có trọng lượng giảm >5%5 | 4,4 | 22,8 | 29,0 | 6,3 |
N | 228 | 224 | 224 | 223 |
SBP (mmHg)3 | ||||
Giá trị ban đầu (trung bình) | 130,4 | 133,0 | 129,9 | 132,5 |
Thay đổi so với ban đầu1 | -0,3 | -2,9 | -3,7 | 0,5 |
Khác biệt so với giả dược1 (KTC 97,5%) | -2,6* (-5,2, -0,0) | -3,4* (-6,0, -0,9) | 0,8 (-1,4, 3,1)4 | |
1 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) sử dụng trở về sau (LOCF). 2 Trung bình được hiệu chỉnh cho giá trị ban đầu và phân tầng. 3 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết và điều trị cứu nguy chống tăng huyết áp) được sử dụng trở về sau (LOCF). 4 Khoảng tin cậy 95%. 5 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm định tuần tự đối với các tiêu chí phụ *p<0,0001. | ||||
– Empagliflozin kết hợp với Metformin
Một nghiên cứu mù đôi, có đối chứng với giả dược kéo dài 24 tuần được tiến hành để đánh giá tính an toàn và hiệu quả của Empagliflozin ở những bệnh nhân không kiểm soát đầy đủ với Metformin. Điều trị với Jardiance dẫn đến cải thiện có ý nghĩa thống kê giá trị HbA1c và trọng lượng cơ thể và giảm có ý nghĩa lâm sàng FPG và huyết áp so với giả dược (Bảng 4).
Trong phần mở rộng mù đôi, có đối chứng với giả dược của nghiên cứu này, giảm HbA1c (thay đổi so với thời điểm ban đầu, giảm 0,62 % ở nhóm dùng Empagliflozin 10mg, giảm 0,74% ở nhóm dùng Empagliflozin 25mg và giảm 0,01% ở nhóm dùng giả dược), trọng lượng cơ thể (thay đổi so với thời điểm ban đầu, giảm 2,39 kg ở nhóm dùng Empagliflozin 10mg, giảm 2,65 kg khi dùng Empagliflozin 25mg và giảm 0,46 kg khi dùng giả dược) và huyết áp (SBP: thay đổi so với thời điểm ban đầu, giảm 5,2mmHg ở nhóm dùng Empagliflozin 10mg, giảm 4,5mmHg ở nhóm dùng Empagliflozin 25mg và tăng 0,8mmHg ở nhóm dùng giả dược, DBP: thay đổi so với thời điểm ban đầu, giảm 2,5mmHg ở nhóm dùng Empagliflozin 10mg, giảm 1,9mmHg ở nhóm dùng Empagliflozin 25mg và giảm 0,5mmHg ở nhóm dùng giả dược) được duy trì cho đến tuần 76.
Bảng 4 – Kết quả nghiên cứu kéo dài 24 tuần (LOCF)3 có đối chứng với giả dược dùng Jardiance kết hợp với Metformin (Bộ phân tích đầy đủ) | |||
Jardiance kết hợp điều trị với Metformin | Giả dược | Empagliflozin 10mg | Empagliflozin 25mg |
N | 207 | 217 | 213 |
HbA1c (%) | |||
Giá trị ban đầu (trung bình) | 7,90 | 7,94 | 7,86 |
Thay đổi so với ban đầu1 | -0,13 | -0,70 | -0,77 |
Khác biệt so với giả dược1 (KTC 97,5%) | -0,57* (-0,72, -0,42) | -0,64* (-0,79, -0,48) | |
N | 184 | 199 | 191 |
Bệnh nhân (%) đạt được HbA1c <7% với giá trị HbA1c ban đầu ≥7%2 | 12,5 | 37,7 | 38,7 |
N | 207 | 216 | 213 |
FPG (mg/dl) [mmol/l]2 | |||
Giá trị ban đầu (trung bình) | 156,0 [8,66] | 154,6 [8,58] | 149,4 [8,29] |
Thay đổi so với ban đầu1 | 6,4 [0,35] | -20,0 [-1,11] | -22,3 [-1,24] |
Khác biệt so với giả dược1 (KTC 95%) | -26,4 (-31,3, -21,6) [-1,47(-1,74, -1,20)] | -28,7 (-33,6, -23,8) [-1,59(-1,86, -1,32)] | |
N | 207 | 217 | 213 |
Trọng lượng cơ thể (kg) | |||
Giá trị ban đầu (trung bình) | 79,73 | 81,59 | 82,21 |
Thay đổi so với ban đầu1 | -0,45 | -2,08 | -2,46 |
Khác biệt so với giả dược1 (KTC 97,5%) | -1,63* (-2,17, -1,08) | -2,01* (-2,56, -1,46) | |
N | 207 | 217 | 213 |
Bệnh nhân (%) có trọng lượng giảm >5%2 | 4,8 | 21,2 | 23,0 |
N | 207 | 217 | 213 |
SBP (mmHg)2 | |||
Giá trị ban đầu (trung bình) | 128,6 | 129,6 | 130,0 |
Thay đổi so với ban đầu1 | -0,4 | -4,5 | -5,2 |
Khác biệt so với giả dược1 (KTC 95%) | -4,1* (-6,2, -2,1) | -4,8* (-6,9, -,7) | |
1 trung bình được hiệu chỉnh cho giá trị ban đầu và phân tầng. 2 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm tra tiếp theo của các tiêu chí phụ. 3 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) được sử dụng trở về sau (LOCF). *giá trị p <0,0001. | |||
– Liệu pháp kết hợp Empagliflozin và Metformin trên bệnh nhân dùng thuốc lần đầu
Một nghiên cứu thiết kế kiểu giai thừa kéo dài 24 tuần được tiến hành để đánh giá tính an toàn và hiệu quả của Empagliflozin ở những bệnh nhân dùng thuốc lần đầu. Điều trị với Empagliflozin kết hợp Metformin (5mg và 500mg; 5mg và 1000mg; 12,5mg và 500mg, và 12,5mg và 1000mg hai lần mỗi ngày) cho thấy sự cải thiện đáng kể có ý nghĩa thống kê giá trị HbA1c và dẫn đến giảm nhiều hơn đáng kể FPG và trọng lượng cơ thể so với việc dùng mỗi thuốc đơn độc. Tỷ lệ bệnh nhân có HbA1c lúc ban đầu ≥ 7,0%, điều trị với Empagliflozin kết hợp Metformin đạt được mục tiêu HbA1c < 7,0% lớn hơn so với dùng mỗi thuốc đơn độc (Bảng 5 và 6).
Bảng 5 – Kết quả nghiên cứu trong 24 tuần (OC) 2 so sánh Empagliflozin 10mg kết hợp Metformin với dùng riêng từng thuốc
Empagliflozin 10mg + Metformin | Empagliflozin 10mg + Metformin 2000mg | Empagliflozin 10mg (qd) | Metformin 1000mga | Metformin 2000mga | |
N | 161 | 167 | 169 | 167 | 162 |
HbA1c (%) | |||||
Giá trị ban đầu (trung bình) | 8,7 | 8,7 | 8,6 | 8,7 | 8,6 |
Thay đổi so với ban đầu1 | -2,0 | -2,1 | -1,4 | -1,2 | -1,8 |
So sánh với Empagliflozin (KTC 95%)1 | -0,6* (-0,9, -0,4)b | -0,7* (-1,0, -0,5)b | |||
So sánh với Metformin (KTC 95%)1 | -0,8* (-1,0, -0,6)b | -0,3* (-0,6, -0,1)b | |||
N | 153 | 161 | 159 | 166 | 159 |
Bệnh nhân (%) đạt được HbA1c <7% với giá trị HbA1c ban đầu ≥7% | 96 (63%) | 112 (70%) | 69 (43%) | 63 (38%) | 92 (58%) |
N | 161 | 166 | 168 | 165 | 164 |
FPG (mg/dL) [mmol/L] | |||||
Thời điểm ban đầu (trung bình) | 165,9 [9,2] | 163,7 [9,1] | 170,0 [9,4] | 172,6 [9,6] | 169,0 [9,4] |
Thay đổi so với ban đầu1 | -45,5 [-2,5] | -47,8 [-2,7] | -32,9 [-1,8] | -17,2 [-1,0] | -32,1 [-1,8] |
So sánh với Empagliflozin (KTC 95%) 1 | -12,6** (-19,1, -6,0)b [-0,7 (-1,1, -0,3)] | -14,8** (-21,4, -8,2)b [-0,8 (-1,2, -0,5)] | |||
So sánh với Metformin (KTC 95%) 1 | -28,2** (-35,0, -21,5)b [-1,6 (-1,9, -1,2)] | -15,6** (-22,3, -8,9)b [-0,9 (-1,2, -0,5)] | |||
N | 161 | 165 | 168 | 166 | 162 |
Trọng lượng cơ thể (kg) | |||||
Thời điểm ban đầu (trung bình) | 82,3 | 83,0 | 83,9 | 82,9 | 83,8 |
Thay đổi so với ban đầu1 | -3,1 | -4,1 | -2,7 | -0,4 | -1,2 |
So sánh với Metformin (KTC 95%)1 | -2,7** (-3,6, –1,8)b | -2,8** (-3,8, -1,9)b | |||
a Được chia thành 2 liều mỗi ngày b Bộ phân tích đầy đủ (quan sát các trường hợp) sử dụng MMRM. Mô hình MMRM bao gồm điều trị, chức năng thận, vùng, thăm khám, thăm khám điều trị tương tác và HbA1c tại thời điểm ban đầu; FPG bao gồm thêm cả FPG tại thời điểm ban đầu; trọng lượng bao gồm thêm cả trọng lượng tại thời điểm ban đầu 1 trung bình được hiệu chỉnh cho giá trị ban đầu 2 Các phân tích được tiến hành trên bộ phân tích đầy đủ (FAS) sử dụng phương pháp các trường hợp ghi nhận (OC) *p≤0,0062 với HbA1c; **Phân tích theo phương pháp thăm dò: p≤0,0002 với FPG và p<0,0001 với trọng lượng cơ thể. | |||||
Bảng 6 – Kết quả nghiên cứu trong 24 tuần (OC)2 so sánh Empagliflozin 25mg kết hợp Metformin với dùng riêng từng thuốc.
Empagliflozin 25mg +Metformin 1000mga | Empagliflozin 25mg +Metformin 2000mga | Empagliflozin 25mg qd | Metformin 1000mga | Metformin 2000mga | |
N | 165 | 169 | 163 | 167 | 162 |
HbA1c (%) | |||||
Giá trị ban đầu (trung bình) | 8,8 | 8,7 | 8,9 | 8,7 | 8,6 |
Thay đổi so với ban đầu1 | -1,9 | -2,1 | -1,4 | -1,2 | -1,8 |
So sánh với Empagliflozin (KTC 95%)1 | -0,6* (-0,8, -0,3)b | -0,7* (-1,0, -0,5)b | |||
So sánh với Metformin (KTC 95%)1 | -0,8* (-1,0, -0,5)b | -0,3* (-0,6, -0,1)b | |||
N | 159 | 163 | 158 | 166 | 159 |
Bệnh nhân (%) đạt được HbA1c <7% với giá trị HbA1c ban đầu ≥7% | 91 (57%) | 111 (68%) | 51 (32%) | 63 (38%) | 92 (58%) |
N | 163 | 167 | 163 | 165 | 164 |
FPG (mg/dL)[mmol/L] | |||||
Giá trị ban đầu (trung bình) | 171,2 [9,5] | 167,9 [9,3] | 176,9 [9,8] | 172,6 [9,6] | 169,0 [9,4] |
Thay đổi so với ban đầu1 | -44,0 [-2,4] | -51,0 [-2,8] | -28,0 [-1,6] | -17,2 [-1,0] | -32,1 [-1,8] |
So sánh với Empagliflozin (KTC 95%)1 | -16,0** (-22,8,-9,2)b [-0,9 (-1,3, -0,5)] | -23,0** (-29,7,-16,3)b [-1,3 (-1,6, -0,9)] | |||
So sánh với Metformin (KTC 95%)1 | -26,7** (-33,5,-20,0)b [-1,5 (-1,9,-1,1)] | -18,8** (-25,5,-12,2)b [-1,0 (-1,4, -0,7)] | |||
N | 165 | 167 | 162 | 166 | 162 |
Trọng lượng cơ thể (kg) | |||||
Giá trị ban đầu | 82,9 | 83,7 | 83,4 | 82,9 | 83,8 |
Thay đổi so với ban đầu1 | -3,6 | -4,3 | -2,8 | -0,4 | -1,2 |
So sánh với Metformin (KTC 95%)1 | -3,1** (-4,1,-2,2)b | -3,1** (-4,1, -2,2)b | |||
a Được chia thành 2 liều mỗi ngày. b Bộ phân tích đầy đủ (quan sát các trường hợp) sử dụng MMRM. Mô hình MMRM bao gồm điều trị, chức năng thận, vùng, thăm khám, thăm khám để điều trị tương tác và HbA1c tại thời điểm ban đầu; FPG bao gồm thêm cả FPG tại thời điểm ban đầu; trọng lượng bao gồm thêm cả trọng lượng tại thời điểm ban đầu. 1 trung bình được hiệu chỉnh cho giá trị ban đầu. 2 Các phân tích được tiến hành trên bộ phân tích đầy đủ (FAS) sử dụng phương pháp t các trường hợp được ghi nhận (OC). *p≤0,0056 với HbA1c. **Phân tích theo phương pháp thăm dò: p≤0,0001 với FPG và p<0,0001 với trọng lượng cơ thể. | |||||
– Empagliflozin kết hợp với liệu pháp phối hợp Metformin và Sulfonylurea
Một nghiên cứu mù đôi, có đối chứng với giả dược kéo dài 24 tuần được tiến hành để đánh giá tính an toàn và hiệu quả của Empagliflozin ở những bệnh nhân không được điều trị thoả đáng với liệu pháp phối hợp Metformin và Sulfonylurea. Điều trị với Jardiance cho thấy sự cải thiện đáng kể có ý nghĩa thống kê trên HbA1c và trọng lượng cơ thể, và sự giảm có ý nghĩa lâm sàng trên FPG và huyết áp so với giả dược (Bảng 7).
Trong phần mở rộng mù đôi, có đối chứng với giả dược của nghiên cứu này, giảm HbA1c (thay đổi so với thời điểm ban đầu: giảm 0,74% khi dùng Empagliflozin 10mg, giảm 0,72% khi dùng Empagliflozin 25mg và giảm 0,03% khi dùng giả dược), trọng lượng cơ thể (thay đổi so với thời điểm ban đầu: giảm 2,44 kg khi dùng Empagliflozin 10mg, giảm 2,28 kg khi dùng Empagliflozin 25mg và giảm 0,63 kg khi dùng giả dược) và huyết áp (thay đổi so với thời điểm ban đầu: SBP: giảm 3,8mmHg khi dùng Empagliflozin 10mg, giảm 3,7mmHg khi dùng Empagliflozin 25mg và giảm 1,6mmHg khi dùng giả dược; DBP: thay đổi so với thời điểm ban đầu: giảm 2,6mmHg khi dùng Empagliflozin 10mg, giảm 2,3mmHg khi dùng Empagliflozin 25mg và giảm 1,4mmHg khi dùng giả dược) được duy trì cho đến tuần 76.
| Bảng 7 – Kết quả nghiên cứu kéo dài 24 tuần điều trị (LOCF)3 có đối chứng với giả dược dùng Jardiance kết hợp điều trị với Metformin và Sulfonylurea (Bộ phân tích đầy đủ). | |||
Jardiance kết hợp điều trị Metformin và Sulfonylurea | Giả dược | Empagliflozin 10mg | Empagliflozin 25mg |
N | 225 | 225 | 216 |
HbA1c (%) |
|
|
|
Giá trị ban đầu (trung bình) | 8,15 | 8,07 | 8,10 |
Thay đổi so với ban đầu1 | -0,17 | -0,82 | -0,77 |
Khác biệt so với giả dược1 (KTC 97,5%) | -0,64* (-0,79, -0,49) | -0,59* (-0,74, -0,44) | |
N | 216 | 209 | 202 |
Bệnh nhân (%) đạt được HbA1c <7% với giá trị HbA1c ban đầu ≥7%2 | 9,3 | 26,3 | 32,2 |
N | 224 | 225 | 215 |
FPG (mg/dl) [mmol/l] | |||
Giá trị ban đầu (trung bình) | 151,7 [8,42] | 151,0 [8,38] | 156,5 [8,68] |
Thay đổi so với ban đầu1 | 5,5 [0,31] | -23,3 [-1,29] | -23,3 [-1,29] |
Khác biệt so với giả dược1 (95%) | -28,8 (-34,3, -23,4) [-1,60 (-1,90, -1,30)] | -28,8 (-34,3, -23,3) [-1,60 (-1,90, -1,29)] | |
N | 225 | 225 | 216 |
Trọng lượng cơ thể (kg) |
|
|
|
Giá trị ban đầu (trung bình) | 76,23 | 77,08 | 77,50 |
Thay đổi so với ban đầu1 | -0,39 | -2,16 | -2,39 |
Khác biệt so với giả dược1 (KTC 97,5%) | -1,76* (-2,25, -1,28) | -1,99* (-2,48, -1,50) | |
N | 225 | 225 | 216 |
Bệnh nhân (%) có trọng lượng giảm >5%2 | 5,8 | 27,6 | 23,6 |
N | 225 | 225 | 216 |
SBP (mmHg)2 | |||
Giá trị ban đầu (trung bình) | 128,8 | 128,7 | 129,3 |
Thay đổi so với ban đầu1 | -1,4 | -4,1 | -3,5 |
Khác biệt so với giả dược1 (KTC 95%) | -2,7 (-4,6, -0,8) | -2,1 (-4,0, -0,2) | |
1 Trung bình được hiệu chỉnh theo giá trị ban đầu và phân tầng 2 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm định tuần tự đối với các tiêu chí phụ 3 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) được sử dụng trở về sau (LOCF) * Giá trị p <0,0001. | |||
– Empagliflozin kết hợp Pioglitazone (+/- Metformin)
Tính an toàn và hiệu quả của Empagliflozin đã được đánh giá trong một nghiên cứu mù đôi, có đối chứng với giả dược, kéo dài 24 tuần ở những bệnh nhân không được kiểm soát đầy đủ với một kết hợp của Metformin và Pioglitazone hoặc Pioglitazone đơn trị liệu. Empagliflozin kết hợp với Pioglitazone (liều ≥30mg) cùng hoặc không cùng Metformin dẫn đến giảm có ý nghĩa thống kê HbA1c, nồng độ đường trong huyết tương lúc đói và trọng lượng cơ thể và giảm huyết áp có ý nghĩa trên lâm sàng so với giả dược (Bảng 8).
Trong phần mở rộng mù đôi, có đối chứng với giả dược của nghiên cứu này, giảm HbA1c (thay đổi so với thời điểm ban đầu, giảm 0,61 % ở nhóm dùng Empagliflozin 10mg, giảm 0,70% ở nhóm dùng Empagliflozin 25mg và giảm 0,01% ở nhóm dùng giả dược), giảm trọng lượng cơ thể (thay đổi so với thời điểm ban đầu, giảm 1,47 kg ở nhóm dùng Empagliflozin 10mg, giảm 1,21 kg khi dùng Empagliflozin 25mg và tăng 0,50 kg khi dùng giả dược) và giảm huyết áp (SBP: thay đổi so với thời điểm ban đầu, giảm 1,7mmHg ở nhóm dùng Empagliflozin 10mg, giảm 3,4mmHg ở nhóm dùng Empagliflozin 25mg và tăng 0,3mmHg ở nhóm dùng giả dược, DBP: thay đổi so với thời điểm ban đầu, giảm 1,3mmHg ở nhóm dùng Empagliflozin 10mg, giảm 2,0mmHg ở nhóm dùng Empagliflozin 25mg và tăng 0,2mmHg ở nhóm dùng giả dược) được duy trì cho đến tuần 76.
| Bảng 8 – Kết quả nghiên cứu kéo dài 24 tuần (LOCF)3 có đối chứng với giả dược dùng Jardiance kết hợp điều trị với Pioglitazone cùng hoặc không cùng với Metformin (Bộ phân tích đầy đủ). | |||
Kết hợp điều trị với Pioglitazone +/- Metformin | Giả dược | Empagliflozin 10mg | Empagliflozin 25mg |
N | 165 | 165 | 168 |
HbA1c (%) | |||
Giá trị ban đầu (trung bình) | 8,16 | 8,07 | 8,06 |
Thay đổi so với ban đầu1 | -0,11 | -0,59 | -0,72 |
Khác biệt so với giả dược1 (KTC 97,5%) | -0,48* (-0,69, -0,27) | -0,61* (-0,82, -0,40) | |
N | 155 | 151 | 160 |
Bệnh nhân (%) đạt được HbA1c <7% với giá trị HbA1c ban đầu ≥7%2 | 7,7 | 23,8 | 30,0 |
N | 165 | 163 | 168 |
FPG (mg/dL) [mmol/L] | |||
Giá trị ban đầu (trung bình) | 151,93 [8,43] | 152,0 [8,44] | 151,86 [8,43] |
Thay đổi so với ban đầu1 | 6,47 [0,37] | -17,0 [-0,94] | -21,99 [-1,23] |
Khác biệt so với giả dược1 (KTC 97,5%) | -23,5* (-31,8, -15,1) [-1,32 (-1,72, -0,91)] | -28,46* (-36,7, -20,2) [-1,61 (-2,01, -1,21)] | |
N | 165 | 165 | 168 |
Trọng lượng cơ thể (kg) | |||
Giá trị ban đầu (trung bình) | 78,1 | 77,97 | 78,93 |
Thay đổi so với ban đầu1 | 0,34 | -1,62 | -1,47 |
Khác biệt so với giả dược1 (KTC 97,5%) | -1,95* (-2,64, -1,27) | -1,81* (-2,49, -1,13) | |
N | 165 | 165 | 168 |
Bệnh nhân (%) có trọng lượng giảm >5%2 | 5,5 | 18,8 | 13,7 |
N | 165 | 165 | 168 |
SBP (mmHg)2 | |||
Giá trị ban đầu (trung bình) | 125,7 | 126,5 | 126 |
Thay đổi so với ban đầu1 | 0,7 | -3,1 | -4,0 |
Khác biệt so với giả dược1 (KTC 95%) | -3,9 (-6,2, -1,5) | -4,7 (-7,1, -2,4) | |
1 trung bình được hiệu chỉnh theo giá trị ban đầu và phân tầng. 2 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm định tuần tự đối với các tiêu chí phụ 3 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) được sử dụng trở về sau (LOCF). *giá trị p < 0,0001. | |||
– Empagliflozin và Linagliptin điều trị bệnh nhân dùng thuốc lần đầu
Sau 24 tuần điều trị với Empagliflozin 25mg/Linagliptin 5mg trên bệnh nhân dùng thuốc lần đầu cho thấy sự cải thiện rõ rệt có ý nghĩa thống kê trên HbA1C so với Linagliptin 5mg nhưng không thấy sự khác biệt đáng kể có ý nghĩa thống kê giữa dạng phối hợp sẵn (FDC) Empagliflozin 25mg/ Linagliptin 5mg và Empagliflozin 25mg (Bảng 9). So với Linagliptin 5mg, cả 2 liều của dạng phối hợp Empagliflozin/ Linagliptin đều cho sự cải thiện tương đối có ý nghĩa thống kê với trọng lượng cơ thể. Sau 24 tuần điều trị với Empagliflozin/ Linagliptin, cả huyết áp tâm thu (SBP) và huyết áp tâm trương (DBP) đều giảm, giảm 2,9/1,1mmHg (không có ý nghĩa so với Linagliptin 5mg với SBP và DBP) khi dùng Empagliflozin 25mg/ Linagliptin 5mg và giảm 3,6/0,7mmHg (p<0,05 so với Linagliptin 5mg với SBP và không có ý nghĩa với DBP) khi dùng Empagliflozin 10mg/ Linagliptin 5mg. Liệu pháp cứu nguy được dùng trên 2 bệnh nhân (1,5%) dùng Empagliflozin 25mg/ Linagliptin 5mg và 1 bệnh nhân (0,7%) dùng Empagliflozin 10mg/ Linagliptin 5mg so với 11 bệnh nhân (8,3%) dùng Linagliptin 5mg, 1 bệnh nhân (0,8%) dùng Empagliflozin 25mg và 4 bệnh nhân (3,0%) dùng Empagliflozin 10mg. Giảm có ý nghĩa lâm sàng trên HbA1c (Bảng 9) và huyết áp tâm thu đã được ghi nhận tại tuần 52, giảm 2,0mmHg (không có ý nghĩa so với Linagliptin 5mg) khi dùng Empagliflozin 25mg/ Linagliptin 5mg và giảm 1,7mmHg (không có ý nghĩa so với Linagliptin 5mg) khi dùng Empagliflozin 10mg/ Linagliptin 5mg.
| Bảng 9 – Kết quả nghiên cứu kéo dài 24 tuần và 52 tuần (LOCF)1 ngẫu nhiên, mù đôi có kiểm chứng điều trị dạng phối hợp Empagliflozin và Linagliptin (Bộ phân tích đầy đủ) | |||||
| Empa 25/Lina 5 | Empa 10/Lina 5 | Empa 25mg | Empa 10mg | Lina 5mg | |
Tiêu chí chính: HbA1c [%] – 24 tuần | |||||
Số bệnh nhân phân tích | 134 | 135 | 133 | 132 | 133 |
Giá trị trung bình ban đầu (SE) | 7,99 (0,08) | 8,04 (0,08) | 7,99 (0,08) | 8,05 (0,09) | 8,05 (0,08) |
Trung bình hiệu chỉnh thay đổi so với giá trị ban đầu tại tuần 241,2 | −1,08 (0,07) | −1,24 (0,07) | −0,95 (0,07) | −0,83 (0,07) | −0,67 (0,07) |
So sánh với Empagliflozin1 | So với empa 25mg | So với empa 10mg | |||
Trung bình hiệu chỉnh2 (SE) | −0,14 (0,10) | −0,41 (0,10) | — | — | — |
KTC 95,0% | −0,33, 0,06 | −0,61, −0,21 | — | — | — |
Giá trị p | 0,1785 | không được đánh giá | — | — | — |
So sánh với Linagliptin 5mg1 | |||||
Trung bình hiệu chỉnh2 (SE) | −0,41 (0,10) | −0,57 (0,10) | — | — | — |
KTC 95,0% | −0,61, −0,22 | −0,76, −0,37 | — | — | — |
Giá trị p | <0,0001 | không được đánh giá | — | — | — |
HbA1c [%] – 52 tuần4 | |||||
Giá trị trung bình ban đầu (SE) | 7,99 (0,08) | 8,04 (0,08) | 7,99 (0,08) | 8,05 (0,09) | 8,05 (0,08) |
Trung bình hiệu chỉnh thay đổi so với giá trị ban đầu tại tuần 521 | −1,17 (0,08) | −1,22 (0,08) | −1,01 (0,08) | −0,85 (0,08) | −0,51 (0,08) |
So sánh với Empagliflozin1 | So với empa 25mg | So với empa 10mg | |||
Trung bình hiệu chỉnh (SE) | −0,16 (0,12) | −0,37 (0,12) | — | — | — |
KTC 95,0% | −0,39, 0,07 | −0,60, −0,14 | — | — | — |
So sánh với Linagliptin 5mg1 | |||||
Trung bình hiệu chỉnh (SE) | −0,66 (0,12) | −0,71 (0,12) | — | — | — |
KTC 95,0% | −0,90, −0,43 | −0,94, −0,48 | — | — | — |
Tiêu chí phụ : FPG [mg/dL] – 24 tuần | |||||
Số bệnh nhân phân tích | 134 | 135 | 133 | 132 | 133 |
Giá trị trung bình ban đầu (SE) | 156,10 (3,09) | 157,18 (3,05) | 152,83 (3,38) | 160,27 (3,59) | 156,03 (3,22) |
Trung bình hiệu chỉnh thay đổi so với giá trị ban đầu tại tuần 241,2 | −29,55 (2,67) | −28,21 (2,66) | −24,24 (2,68) | −22,39 (2,69) | −5,92 (2,68) |
So sánh với Empagliflozin1 | So với empa 25mg | So với empa 10mg | |||
Trung bình hiệu chỉnh2 (SE) | −5,31 (3,78) | −5,82 (3,78) | — | — | — |
KTC 95,0% | −12,74, 2,11 | −13,25, 1,61 | — | — | — |
Giá trị p | không được đánh giá | không được đánh giá | — | — | — |
So sánh với Linagliptin 5mg1 | |||||
Trung bình hiệu chỉnh2 (SE) | −23,63 (3,78) | −22,29 (3,77) | — | — | — |
KTC 95,0% | −31,06, −16,21 | −29,71, −14,88 | — | — | — |
Giá trị p | không được đánh giá | không được đánh giá | — | — | — |
Tiêu chí phụ : trọng lượng cơ thể [kg] – 24 tuần | |||||
Số bệnh nhân phân tích | 134 | 135 | 133 | 132 | 133 |
Giá trị trung bình ban đầu (SE) | 87,92 (1,57) | 87,30 (1,59) | 86,73 (1,71) | 87,82 (2,08) | 89,51 (1,74) |
Trung bình hiệu chỉnh thay đổi so với giá trị ban đầu tại tuần 241,3 | −2,00 (0,36) | −2,74 (0,36) | −2,13 (0,36) | −2,27 (0,37) | −0,78 (0,36) |
So sánh với Linagliptin 5mg1 | |||||
Trung bình hiệu chỉnh2 (SE) | −1,22 (0,51) | −1,96 (0,51) | — | — | — |
KTC 95,0% | −2,23, −0,21 | −2,97, −0,95 | — | — | — |
Giá trị p | không được đánh giá | không được đánh giá | — | — | — |
Tiêu chí phụ : bệnh nhân với HbA1c <7,0% – 24 tuần | |||||
Số lượng bệnh nhân, N (%) | 121 (100,0) | 122 (100,0) | 118 (100,0) | 121 (100,0) | 127 (100,0) |
Với HbA1c <7,0% ở tuần 24 | 67 (55,4) | 76 (62,3) | 49 (41,5) | 47 (38,8) | 41 (32,3) |
So sánh với 5 Empagliflozin | So với empa 25mg | So với empa 10mg | |||
Tỷ số chênh (OR) | 1,893 | 2,961 | — | — | — |
KTC 95,0% | 1,095, 3,274 | 1,697, 5,169 | — | — | — |
Giá trị p | không được đánh giá | không được đánh giá | — | — | — |
So sánh với 5 Lina 5mg | |||||
Tỷ số chênh (OR) | 3,065 | 4,303 | — | — | — |
KTC 95,0% | 1,768, 5,314 | 2,462, 7,522 | — | — | — |
Giá trị p | không được đánh giá | không được đánh giá | — | — | — |
1 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) được sử dụng trở về sau (LOCF). 2 trung bình được hiệu chỉnh theo giá trị ban đầu và phân tầng. 3 Mô hình ANCOVA bao gồm trọng lượng cơ thể ban đầu, HbA1c ban đầu, eGFR (MDRD) ban đầu, vùng địa lý, và điều trị; dựa trên FAS (LOCF). So sánh với Empagliflozin đã được thăm dò và không phải một phần của trình tự kiểm định (empa 25mg / Lina 5mg so với empa 25mg: trung bình hiệu chỉnh 0,19 (KTC 95% −0,65, 1,03) kg; empa 10mg / Lina 5mg so với empa 10: −0,07 (−0,91, 0,77) kg). 4 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm định tuần tự đối với tiêu chí phụ. Tiêu chuẩn “không được đánh giá” nghĩa là phép thử theo trình tự trước đó trong chuỗi xác nhận không đạt nên phép thử tiếp theo không được tiến hành. 5 Hồi quy Logistic bao gồm HbA1c ban đầu, eGFR (MDRD) ban đầu, vùng địa lý, và điều trị; dựa trên FAS (NCF), bệnh nhân với HbA1c ban đầu ≥ 7%. | |||||
Trong một phân nhóm bệnh nhân đã được xác định trước, với HbA1c ban đầu ≥ 8,5%, HbA1c so với giá trị ban đầu giảm 1,9% ở tuần 24 khi dùng Empagliflozin 25mg/ Linagliptin 5mg (p < 0,0001 so với Linagliptin 5mg, không có ý nghĩa so với Empagliflozin 25mg) và giảm 2,0% ở tuần 52 (p < 0,0001 so với Linagliptin 5mg, p < 0,05 so với Empagliflozin 25mg); giảm 1,9% ở tuần 24 khi dùng Empagliflozin 10mg/ Linagliptin 5mg (p < 0,0001 so với Linagliptin 5mg, p < 0,05 so với Empagliflozin 10mg) và giảm 2,0% ở tuần 52 (p < 0,0001 so với Linagliptin 5mg, p < 0,05 so với Empagliflozin 10mg).
– Empagliflozin và Linagliptin kết hợp với Metformin
Ở những bệnh nhân không được kiểm soát đầy đủ với việc điều trị bằng Metformin trong 24 tuần, dùng dạng phối hợp sẵn (FDC) Empagliflozin/Linagliptin cả hai hàm lượng cho thấy có sự cải thiện đáng kể có ý nghĩa thống kê trên HbA1c và đường huyết khi đói so với dùng Linagliptin 5mg và cả Empagliflozin 10mg hay 25mg. So với Linagliptin 5mg, cả hai hàm lượng của dạng phối hợp Empagliflozin/Linagliptin cho thấy sự cải thiện đáng kể có ý nghĩa thống kê trên cân nặng.
Tỷ lệ bệnh nhân với mức HbA1c ban đầu ≥7,0%, dùng dạng phối hợp Empagliflozin/Linagliptin đạt được mục tiêu HbA1c < 7% cao hơn so với dùng từng thành phần riêng lẻ (Bảng 9).
Sau 24 tuần điều trị với Empagliflozin/Linagliptin, cả huyết áp tâm thu và huyết áp tâm trương đều giảm, giảm 5,6/3,6mmHg (p<0,001 so với Linagliptin 5mg cho SBP và DBP) khi dùng Empagliflozin 25mg/Linagliptin 5mg và giảm 4,1/2,6mmHg (p<0,05 so với Linagliptin 5mg cho SBP, không có ý nghĩa với DBP) khi dùng Empagliflozin 10mg/Linagliptin 5mg. Ghi nhận thấy có sự giảm có ý nghĩa lâm sàng trên HbA1C (Bảng 10) và cả huyết áp tâm thu và huyết áp tâm trương ở tuần 52, giảm 3,8/1,6mmHg (p<0,05 so với Linagliptin 5mg với SBP và DBP) khi dùng Empagliflozin 25mg/Linagliptin 5mg và giảm 3,1/1,6mmHg (p<0,05 so với Linagliptin 5mg với SBP, không có ý nghĩa với DBP) khi dùng Empagliflozin 10mg/Linagliptin 5mg.
Sau 24 tuần, đã sử dụng liệu pháp cứu nguy trên 1 bệnh nhân (0,7%) dùng Empagliflozin 25mg/Linagliptin 5mg và trên 3 bệnh nhân (2,2%) dùng Empagliflozin 10mg /Linagliptin 5mg, so với 4 bệnh nhân (3,1%) dùng Linagliptin 5mg; 6 bệnh nhân (4,3%) dùng Empagliflozin 25mg và 1 bệnh nhân (0,7%) dùng Empagliflozin 10mg.
Bảng 10 – Kết quả nghiên cứu ngẫu nhiên, mù đôi có kiểm chứng kéo dài 24 tuần và 52 tuần (LOCF)1 sử dụng dạng phối hợp sẵn (FDC) Empagliflozin và Linagliptin trên bệnh nhân không được kiểm soát đầy đủ khi điều trị bằng Metformin. | |||||
Empa 25/Lina 5 | Empa 10/Lina 5 | Empa 25mg | Empa 10mg | Lina 5mg | |
Tiêu chí chính : HbA1c [%] – 24 tuần | |||||
Số bệnh nhân phân tích | 134 | 135 | 140 | 137 | 128 |
Giá trị trung bình ban đầu (SE) | 7,90 (0,07) | 7,95 (0,07) | 8,02 (0,07) | 8,00 (0,08) | 8,02 (0,08) |
Trung bình hiệu chỉnh thay đổi so với giá trị ban đầu tại tuần 241,2 | −1,19 (0,06) | −1,08 (0,06) | −0,62 (0,06) | −0,66 (0,06) | −0,70 (0,06) |
So sánh với Empagliflozin1 | So với empa 25mg | So với empa 10mg | |||
Trung bình hiệu chỉnh2 (SE) | −0,58 (0,09) | −0,42 (0,09) | — | — | — |
KTC 95,0% | −0,75, −0,41 | −0,59, −0,25 | — | — | — |
Giá trị p | <0,0001 | <0,0001 | — | — | — |
So sánh với Linagliptin 5mg1 | |||||
Trung bình hiệu chỉnh2 (SE) | −0,50 (0,09) | −0,39 (0,09) | — | — | — |
KTC 95,0% | −0,67, −0,32 | −0,56, −0,21 | — | — | — |
Giá trị p | <0,0001 | <0,0001 | — | — | — |
HbA1c [%] -52 tuần4 | |||||
Giá trị trung bình ban đầu (SE) | 7,90 (0,07) | 7,95 (0,07) | 8,02 (0,07) | 8,00 (0,08) | 8,02 (0,08) |
Trung bình hiệu chỉnh thay đổi so với giá trị ban đầu tại tuần 521,2 | −1,21 (0,07) | −1,05 (0,07) | −0,64 (0,07) | −0,69 (0,07) | −0,48 (0,07) |
So sánh với Empagliflozin1 | So với empa 25mg | So với empa 10mg | |||
Trung bình hiệu chỉnh2 (SE) | −0,57 (0,10) | −0,36 (0,10) | — | — | — |
KTC 95,0% | −0,77, −0,37 | −0,56, −0,17 | — | — | — |
So sánh với Linagliptin 5mg1 | |||||
Trung bình hiệu chỉnh2 (SE) | −0,73 (0,10) | −0,57 (0,10) | — | — | — |
KTC 95,0% | −0,93, −0,53 | −0,77, −0,37 | — | — | — |
Tiêu chí phụ : FPG [mg/dL] – 24 tuần | |||||
Số bệnh nhân phân tích | 133 | 134 | 139 | 136 | 127 |
Giá trị trung bình ban đầu (SE) | 154,62 (2,89) | 156,68 (2,98) | 159,89 (3,21) | 161,64 (2,98) | 156,35 (2,72) |
Trung bình hiệu chỉnh thay đổi so với giá trị ban đầu tại tuần 241,2 | −35,25 (2,53) | −32,18 (2,52) | −18,83 (2,47) | −20,84 (2,50) | −13,05 (2,59) |
So sánh với Empagliflozin1 | So với empa 25mg | So với empa 10mg | |||
Trung bình hiệu chỉnh2 (SE) | −16,43 (3,54) | −11,34 (3,55) | — | — | — |
KTC 95,0% | −23,37,−9,48 | −18,31, −4,37 | — | — | — |
| Giá trị | <0,0001 | 0,0015 | — | — | — |
So sánh với Linagliptin 5mg1 | |||||
Trung bình hiệu chỉnh2 (SE) | −22,20 (3,62) | −19,12 (3,61) | — | — | — |
KTC 95,0% | −29,30, −15,10 | −26,21, −12,03 | — | — | — |
Giá trị p | <0,0001 | <0,0001 | — | — | — |
Tiêu chí phụ: trọng lượng cơ thể [kg] – 24 tuần | |||||
Số bệnh nhân phân tích | 134 | 135 | 140 | 137 | 128 |
Giá trị trung bình ban đầu (SE) | 85,47 (1,76) | 86,57 (1,64) | 87,68 (1,49) | 86,14 (1,55) | 85,01 (1,62) |
Trung bình hiệu chỉnh thay đổi so với giá trị ban đầu tại tuần 241,2,3 | −2,99 (0,31) | −2,60 (0,30) | −3,18 (0,30) | −2,53 (0,30) | −0,69 (0,31) |
So sánh với Linagliptin 5mg1 | |||||
Trung bình hiệu chỉnh2 (SE) | −2,30 (0,44) | −1,91 (0,44) | — | — | — |
KTC 95,0% | −3,15, −1,44 | −2,77, −1,05 | — | — | — |
Giá trị p | <0,0001 | <0,0001 | — | — | — |
Tiêu chí phụ : bệnh nhân với HbA1c <7,0% – 24 tuần | |||||
Số lượng bệnh nhân, N (%) | 123 (100,0) | 128 (100,0) | 132 (100,0) | 125 (100,0) | 119 (100,0) |
Với HbA1c <7,0% ở tuần 24 | 76 (61,8) | 74 (57,8) | 43 (32,6) | 35 (28,0) | 43 (36,1) |
So sánh5 với Empagliflozin | So với empa 25mg | So với empa 10mg | |||
Tỷ số chênh (OR) | 4,191 | 4,500 | — | — | — |
KTC 95,0% | 2,319, 7,573 | 2,474, 8,184 | — | — | — |
Giá trị p | <0,0001 | <0,0001 | — | — | — |
So sánh5 với Lina 5mg | |||||
Tỷ số chênh (OR) | 3,495 | 2,795 | — | — | — |
KTC 95,0% | 1,920, 6,363 | 1,562, 5,001 | — | — | — |
Giá trị p | <0,0001 | 0,0005 | — | — | — |
1 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) được sử dụng trở về sau (LOCF). 2 Trung bình được hiệu chỉnh theo giá trị ban đầu và phân tầng. 3 Mô hình ANCOVA bao gồm trọng lượng cơ thể ban đầu, HbA1c ban đầu, eGFR (MDRD) ban đầu, vùng địa lý, và điều trị; dựa trên FAS (LOCF). So sánh với Empagliflozin đã được thăm dò và không phải một phần của trình tự kiểm định (empa 25 / Lina 5 so với empa 25: trung bình hiệu chỉnh 0,19 (KTC 95% −0,65, 1,03) kg; empa 10 / Lina 5 so với empa 10: −0,07 (−0,91, 0,77) kg). 4 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm định tuần tự cho tiêu chí phụ. 5 Hồi quy Logistic bao gồm HbA1c ban đầu, eGFR (MDRD) ban đầu, vùng địa lý, và điều trị; dựa trên FAS (NCF), bệnh nhân với HbA1c ban đầu ≥ 7%. | |||||
Trong một phân nhóm bệnh nhân đã được xác định trước, với HbA1c ban đầu ≥ 8,5%, HbA1c so với giá trị ban đầu giảm 1,8% ở tuần 24 khi dùng Empagliflozin 25mg/ Linagliptin 5mg (p < 0,0001 so với Linagliptin 5mg, p<0,001 so với Empagliflozin 25mg) và giảm 1,8% ở tuần 52 (p < 0,0001 so với Linagliptin 5mg, p < 0,05 so với Empagliflozin 25mg); giảm 1,6% ở tuần 24 khi dùng Empagliflozin 10mg/ Linagliptin 5mg (p < 0,01 so với Linagliptin 5mg, không có ý nghĩa so với Empagliflozin 10mg) và giảm 1,5% ở tuần 52 (p < 0,01 so với Linagliptin 5mg, không có ý nghĩa so với Empagliflozin 10mg).
– Empagliflozin so với giả dược ở bệnh nhân không được kiểm soát đầy đủ bằng Metformin và Linagliptin
Ở bệnh nhân không được kiểm soát đầy đủ bằng Metformin và Linagliptin, việc điều trị trong vòng 24 tuần với cả hai mức liều (10mg và 25mg) Empagliflozin cho thấy cải thiện có ý nghĩa thống kê các giá trị HbA1c, FPG và trọng lượng cơ thể so với giả dược (sử dụng thuốc nền Linagliptin 5mg). Số bệnh nhân có HbA1c ban đầu ≥ 7,0% và điều trị đạt đích HbA1c < 7% ở nhóm dùng Empagliflozin cao hơn có ý nghĩa thống kê so với nhóm dùng giả dược (sử dụng thuốc nền là Linagliptin 5mg) (Bảng 11). Sau 24 tuần điều trị bằng Empagliflozin, cả SBP và DBP đều giảm – 2,6/-1,1mmHg (SBP và DBP đều giảm không có ý nghĩa thống kê so với nhóm dùng giả dược) ở nhóm dùng Empagliflozin 25mg/Linagliptin 5mg và -1,3/-0,1mmHg (SBP và DBP đều giảm không có ý nghĩa thống kê so với nhóm dùng giả dược) ở nhóm dùng Empagliflozin 10mg/Linagliptin 5mg.
Sau 24 tuần, phác đồ cứu nguy được sử dụng trên 4 (3,6%) bệnh nhân ở nhóm dùng Empagliflozin 25mg/Linagliptin 5mg và 2 (1,8%) bệnh nhân ở nhóm dùng Empagliflozin 10mg/Linagliptin 5mg so với 13 (12,0%) bệnh nhân ở nhóm dùng giả dược (sử dụng thuốc nền là Linagliptin 5mg).
Bảng 11. Các thông số so sánh hiệu quả của Empagliflozin so với giả dược được sử dụng là phác đồ hỗ trợ trên bệnh nhân không được kiểm soát đầy đủ bằng Metformin và Linagliptin 5mg | |||
Metformin + Linagliptin 5mg | |||
Empagliflozin 10mg1 | Empagliflozin 25mg1 | Giả dược2 | |
HbA1c (%) – 24 tuần3 | |||
N | 109 | 110 | 106 |
Giá trị ban đầu (trung bình) | 7,97 | 7,97 | 7,96 |
Thay đổi so với ban đầu (trung bình hiệu chỉnh) | -0,65 | -0,56 | 0,14 |
Khác biệt so với giả dược (trung bình hiệu chỉnh) (KTC 95%)2 | -0,79 (-1,02, -0,55) p<0,0001 | -0,70 (-0,93, -0,46) p<0,0001 | |
FPG (mg/dL) – 24 tuần3 | |||
N | 109 | 109 | 106 |
Giá trị ban đầu (trung bình) | 9,32 | 9,44 | 9,04 |
Thay đổi so với ban đầu (trung bình hiệu chỉnh) | -1,46 | -1,75 | 0,34 |
Khác biệt so với giả dược (trung bình hiệu chỉnh) (KTC 95%) | -1,80 (-2,31, -1,28) p<0,0001 | -2,09 (-2,61,-1,57) p<0,0001 | |
Trọng lượng cơ thể-24 tuần3 | |||
N | 109 | 110 | 106 |
Giá trị ban đầu (trung bình) theo kg | 88,4 | 84,4 | 82,3 |
Thay đổi so với ban đầu (trung bình hiệu chỉnh) | -3,1 | -2,5 | -0,3 |
Khác biệt so với giả dược (trung bình hiệu chỉnh) (KTC 95%)1 | -2,8 ( 3,5; 2,1) p<0,0001 | -2,2 ( 2,9, 1,5) p<0,0001 | |
Số bệnh nhân (%) đạt HbA1c <7% với giá trị HbA1c ban đầu ≥7% – 24 tuần4 | |||
N | 100 | 107 | 100 |
Số bệnh nhân (%) đạt A1C <7% | 37,0 | 32,7 | 17,0 |
Khác biệt so với giả dược (tỷ số chênh) (KTC 95%)5 | 4,0 (1,9; 8,7) | 2,9 (1,4; 6,1) | |
1 Bệnh nhân được phân ngẫu nhiên vào nhóm sử dụng Empagliflozin 10mg/Linagliptin 5mg hoặc Empagliflozin 25mg/Linagliptin 5mg và sử dụng thuốc nền Metformin. 2 Bệnh nhân được phân ngẫu nhiên vào nhóm sử dụng giả dược kết hợp Linagliptin 5mg và sử dụng thuốc nền Metformin. 3 Mô hình MMRM trên FAS (OC) bao gồm giá trị HbA1c ban đầu, giá trị eGFR (MDRD) ban đầu, vùng địa lý sinh sống, liệu pháp điều trị trong mỗi lần thăm khám và tương tác trong mỗi lần thăm khám. Với FPG, bao gồm cả giá trị FPG ban đầu. Với trọng lượng cơ thể, bao gồm cả giá trị trọng lượng cơ thể ban đầu. 4 Không được đánh giá ý nghĩa thống kê; không nằm trong quy trình thử đánh giá các tiêu chí thứ cấp. 5 Hồi quy logistic trên FAS (NCF) bao gồm các giá trị HbA1c ban đầu, eGFR (MDRD) ban đầu, vùng địa lý sinh sống và các liệu pháp điều trị tiến hành trên bệnh nhân có HbA1c ban đầu ≥ 7%. | |||
Trong một phân nhóm định trước gồm các bệnh nhân có giá trị HbA1c ban đầu từ 8,5% trở lên, mức giảm HbA1c so với giá trị ban đầu ở nhóm Empagliflozin 25mg/Linagliptin 5mg tại thời điểm 24 tuần là -1,3% (p<0,0001 so với giả dược [sử dụng thuốc nền Linagliptin 5mg]) và ở nhóm Empagliflozin 10mg/Linagliptin 5mg là -1,3% (p<0,0001 so với giả dược [sử dụng thuốc nền Linagliptin 5mg]).
– Empagliflozin kết hợp với metformin so với glimepiride, dữ liệu 2 năm
Trong một nghiên cứu so sánh tính an toàn và hiệu quả của empagliflozin 25mg so với glimepiride (4mg) ở những bệnh nhân không kiểm soát đường huyết đầy đủ với metformin đơn trị, điều trị với empagliflozin 25mg hàng ngày dẫn đến giảm HbA1c vượt trội và giảm FPG có ý nghĩa lâm sàng so với glimepiride (Bảng 12). Empagliflozin 25mg dùng hàng ngày dẫn đến giảm có ý nghĩa thống kê trọng lượng cơ thể, huyết áp tâm thu và tâm trương (thay đổi so với thời điểm ban đầu, giảm huyết áp tâm trương 1,8mmHg khi dùng empagliflozin và tăng 0,9mmHg khi dùng glimepiride, p<0,0001).
Điều trị với empagliflozin 25mg hàng ngày dẫn đến tỷ lệ thấp hơn có ý nghĩa thống kê về biến cố hạ đường huyết ở bệnh nhân so với glimepiride (2,5% với empagliflozin 25mg, 24,2% với glimepiride, p<0,0001).
| Bảng 12. Kết quả nghiên cứu kéo dài 104 tuần điều trị (LOCF)4 so sánh empagliflozin phối hợp metformin với hoạt chất glimepiride (Bộ phân tích đầy đủ) | ||
Empagliflozin phối hợp metformin so sánh với glimepiride | Empagliflozin 25mg | Glimepiride (đến liều 4mg) |
N | 765 | 780 |
HbA1c (%) | ||
Giá trị trung bình ban đầu | 7,92 | 7,92 |
Thay đổi so với ban đầu1 | -0,66 | -0,55 |
Khác biệt so với glimepiride1 (KTC 97,5%) | -0,11* (-0,20, -0,01) | |
N | 690 | 715 |
Bệnh nhân (%) đạt HbA1c <7% với HbA1c ban đầu ≥7%2 | 33,6 | 30,9 |
N | 764 | 779 |
FPG (mg/dL)2 | ||
Giá trị trung bình ban đầu | 150,00 | 149,82 |
Thay đổi so với ban đầu1 | -15,36 | -2,98 |
Khác biệt so với glimepiride1 (KTC 95%) | -12,37(-15,47,-9,27) | |
N | 765 | 780 |
Trọng lượng cơ thể (kg) | ||
Giá trị trung bình ban đầu | 82,52 | 83,03 |
Thay đổi so với ban đầu1 | -3,12 | 1,34 |
Khác biệt so với glimepiride1 (KTC 97,5%) | -4,46** (-4,87, -4,05) | |
N | 765 | 780 |
Bệnh nhân (%) có trọng lượng cơ thể giảm >5%2 | 27,5 | 3,8 |
N | 765 | 780 |
SBP (mmHg)3 | ||
Giá trị trung bình ban đầu | 133,4 | 133,5 |
Thay đổi so với ban đầu1 | -3,1 | 2,5 |
Khác biệt so với glimepiride1 (KTC 97,5%) | -5,6** (-7,0,-4,2) | |
1 Trung bình được hiệu chỉnh theo giá trị ban đầu và phân tầng. 2 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm định tuần tự cho tiêu chí phụ. 3 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết hoặc cứu nguy chống tăng huyết áp) được sử dụng trở về sau (LOCF). 4 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) được sử dụng trở về sau (LOCF). * Giá trị p <0,0001 không thua kém, và p=0,0153 vượt trội. **Giá trị p <0,0001. | ||
– Empagliflozin kết hợp với insulin MDI và metformin
Tính an toàn và hiệu quả của empagliflozin kết hợp với insulin dùng nhiều lần trong ngày cùng hoặc không cùng với metformin (71,0% bệnh nhân có dùng metformin) đã được đánh giá trong một thử nghiệm mù đôi, có kiểm chứng với giả dược kéo dài 52 tuần. Trong suốt 18 tuần đầu và 12 tuần cuối, liều insulin được giữ ổn định, nhưng được điều chỉnh từ tuần 19 đến tuần 40 để đạt được mức đường huyết trước khi ăn <100mg/dl [5,5mmol/l], và đường huyết sau khi ăn <140mg/dl [7,8mmol/l].
Ở tuần 18, empagliflozin cho thấy sự cải thiện đáng kể có ý nghĩa thống kê trên HbA1c so với giả dược (Bảng 13). Tỷ lệ bệnh nhân có HbA1c ban đầu ≥7.0% (19,5% ở nhóm dùng empagliflozin 10mg, 31,0% ở nhóm dùng empagliflozin 25mg) đạt được mục tiêu HbA1c <7% lớn hơn so với nhóm dùng giả dược (15,1%).
Ở tuần 52, điều trị với empagliflozin làm giảm đáng kể có ý nghĩa thống kê HbA1c và insulin so với giả dược và giảm FPG (thay đổi so với ban đầu: giảm 0,3mg/dl [0,02mmol/l] ở nhóm dùng giả dược, giảm 19,7mg/dl [1,09mmol/l] ở nhóm dùng empagliflozin 10mg, và giảm 23,7mg/dl [1,31mmol/l] ở nhóm dùng empagliflozin 25mg), trọng lượng cơ thể, và huyết áp (SBP: thay đổi so với ban đầu: giảm 2,6mmHg ở nhóm dùng giả dược, giảm 3,9mmHg ở nhóm dùng empagliflozin 10mg và giảm 4,0mmHg ở nhóm dùng empagliflozin 25mg, DBP: thay đổi so với thời điểm ban đầu: giảm 1,0mmHg ở nhóm dùng giả dược, giảm 1,4mmHg ở nhóm dùng empagliflozin 10mg và giảm 2,6mmHg ở nhóm dùng empagliflozin 25mg).
| Bảng 13. Kết quả nghiên cứu có đối chứng với giả dược kéo dài 18 tuần và 52 tuần (LOCF)5 empagliflozin phối hợp insulin dùng nhiều lần trong ngày và metformin | |||
Empagliflozin kết hợp với Insulin và metformin | Giả dược | Empagliflozin 10mg | Empagliflozin 25mg |
N | 188 | 186 | 189 |
HbA1c (%) ở tuần 18 | |||
Giá trị trung bình ban đầu | 8,33 | 8,39 | 8,29 |
Thay đổi so với ban đầu1 | -0,50 | -0,94 | -1,02 |
Khác biệt so với giả dược1 (KTC 97,5%) | -0,44* (-0,61, -0,27) | -0,52* (-0,69, -0,35) | |
N | 115 | 119 | 118 |
HbA1c (%) ở tuần 523 | |||
Giá trị trung bình ban đầu | 8,25 | 8,40 | 8,37 |
Thay đổi so với ban đầu1 | -0,81 | -1,18 | -1,27 |
Khác biệt so với giả dược1 (KTC 97,5%) | -0,38** (-0,62, -0,13) | -0,46* (-0,70, -0,22) | |
N | 113 | 118 | 118 |
Bệnh nhân (%) đạt HbA1c <7% với HbA1c ban đầu ≥7% ở tuần 524 | 26,5 | 39,8 | 45,8 |
N | 188 | 186 | 189 |
FPG (mg/dL) [mmol/L] ở tuần 525 | |||
Giá trị trung bình ban đầu | 151,6 [8,41] | 159,1 [8,83] | 150,3 [8,34] |
Thay đổi so với ban đầu1 | -0,3 [-0,02] | -19,7 [-1,09] | -23,7 [-1,31] |
Khác biệt so với giả dược1 (KTC 95%) |
| -19,3 (-27,9, -10,8) [-1,07 (-1,55, -0,6)] | -23,4 (-31,8, -14,9) [-1,30 (-1,77, -0,83)] |
N | 115 | 118 | 117 |
Liều Insulin (IU/ngày) ở tuần 523 | |||
Giá trị trung bình ban đầu | 89,94 | 88,57 | 90,38 |
Thay đổi so với ban đầu1 | 10,16 | 1,33 | -1,06 |
Khác biệt so với giả dược1 (KTC 97,5%) | -8,83** (-15,69, – 1,97) | -11,22**(-18,09, -4,36) | |
N | 115 | 119 | 118 |
Trọng lượng cơ thể (kg) ở tuần 523 | |||
Giá trị trung bình ban đầu | 96,34 | 96,47 | 95,37 |
Thay đổi so với ban đầu1 | 0,44 | -1,95 | -2,04 |
Khác biệt so với giả dược1 (KTC 97,5%) | -2,39* (-3,54, -1,24) | -2,48* (-3,63, -1,33) | |
N | 188 | 186 | 189 |
| SBP (mmHg)6 | |||
Giá trị trung bình ban đầu | 132,6 | 134,2 | 132,9 |
| Thay đổi so với ban đầu1,4 | -2,6 | -3,9 | -4,0 |
Khác biệt so với giả dược1 (KTC 97,5%) |
-1,4 (-3,6, 0,9) | -1,4 (-3,7, 0,8) | |
1 Trung bình đã được hiệu chỉnh theo giá trị ban đầu và phân tầng. 2 Tuần 18: FAS; tuần 52: PPS-bổ sung-52. 3 Tuần 19-40: liệu pháp điều trị mục tiêu điều chỉnh liều insulin để đạt mức đường huyết mục tiêu (trước ăn <100mg/dl (5,5mmol/l), sau ăn <140mg/dl (7,8mmol/l). 4 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm định tuần tự cho tiêu chí phụ. 5 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) được sử dụng trở về sau (LOCF). 6 Tuần 52: FAS. * Giá trị p <0,0001. ** Giá trị p <0,005. | |||
– Empagliflozin kết hợp điều trị với insulin nền
Tính an toàn và hiệu quả của empagliflozin (10mg hoặc 25mg) kết hợp điều trị với insulin nền cùng hoặc không cùng với metformin và/hoặc sulfonylurea được đánh giá trong một nghiên cứu mù đôi, có đối chứng với giả dược kéo dài 78 tuần. Trong giai đoạn khởi đầu 18 tuần liều của insulin được giữ ổn định, nhưng được điều chỉnh sau 60 tuần để đạt được FPG < 110mg/dL.
Ở tuần 18, empagliflozin (10mg hoặc 25mg) cho thấy giá trị HbA1c cải thiện có ý nghĩa thống kê so với giả dược. Tỉ lệ bệnh nhân có HbA1c ban đầu ≥7,0% đạt được HbA1c mục tiêu < 7% lớn hơn so với giả dược. Ở tuần 78, empagliflozin làm giảm HbA1c và liều insulin có ý nghĩa thống kê so với giả dược (bảng 14).
Ở tuần 78, empagliflozin làm giảm FPG 10,51mg/dL [giảm 0,58mmol/L] khi dùng empagliflozin 10mg, giảm 17,43mg/dL [0,3mmol/L] khi dùng empagliflozin 25mg và giảm 5,48mg/dL [giảm 0,97mmol/L] đối với giả dược, trọng lượng cơ thể (giảm 2,47 kg khi dùng empagliflozin 10mg, giảm 1,96 kg ở nhóm dùng empagliflozin 25mg và tăng 1,16 kg ở nhóm dùng giả dược, p<0,0001), huyết áp (SBP: giảm 4,1mmHg đối với empagliflozin 10mg, giảm 2,4mmHg ở nhóm dùng empagliflozin 25mg và tăng 0,1mmHg ở nhóm dùng giả dược; DBP: giảm 2,9mmHg đối với empagliflozin 10mg, giảm 1,5mmHg ở nhóm dùng empagliflozin 25mg và giảm 0,3mmHg ở nhóm dùng giả dược).
| Bảng 14. Kết quả nghiên cứu có đối chứng với giả dược tuần 18 và 78 của JARDIANCE kết hợp điều trị với insulin nền cùng hoặc không cùng với metformin hoặc sulphonylurea (LOCF) (Bộ phân tích đầy đủ). | |||
Kết hợp điều trị với insulin nền +/- metformin hoặc sulfonylurea | Giả dược | Empagliflozin 10mg | Empagliflozin 25mg |
N | 125 | 132 | 117 |
HbA1c (%) ở tuần 18 | |||
Giá trị ban đầu (trung bình) | 8,10 | 8,26 | 8,34 |
Thay đổi so với ban đầu1 | -0,01 | -0,57 | -0,71 |
Khác biệt so với giả dược1 (KTC 97,5%) | -0,56* (-0,78, -0,33) | -0,70* (-0,93, -0,47) | |
N | 112 | 127 | 110 |
HbA1c (%) ở tuần 18 | |||
Giá trị ban đầu (trung bình) | 8,09 | 8,27 | 8,29 |
Thay đổi so với ban đầu1 | -0,02 | -0,48 | -0,64 |
Khác biệt so với giả dược1 (KTC 97,5%) | -0,46* (-0,73, -0,19) | -0,62* (-0,90, -0,34) | |
N | 112 | 127 | 110 |
Liều insulin nền (IU/ngày) ở tuần 78 | |||
Giá trị ban đầu (trung bình) | 47,84 | 45,13 | 48,43 |
Thay đổi so với ban đầu1 | 5,45 | -1,21 | -0,47 |
Khác biệt so với giả dược1 (KTC 97,5%) | -6,66**(-11,56,-1,77) | -5,92** (-11,00,-0,85) | |
– Empagliflozin kết hợp điều trị với ức chế dipeptidyl peptidase 4 (DPP-4)
Tính an toàn và hiệu quả của empagliflozin kết hợp điều trị với các chất ức chế DPP-4 và metformin, cùng hoặc không cùng với một thuốc chống đái tháo đường dạng uống được đánh giá ở 160 bệnh nhân có nguy cơ tim mạch cao. Điều trị với empagliflozin trong 28 tuần làm giảm HbA1c so với giả dược (thay đổi so với thời điểm ban đầu giảm 0,54% ở nhóm dùng empagliflozin 10mg, giảm 0,52% ở nhóm dùng empagliflozin 25mg và giảm 0,02 ở nhóm dùng giả dược).
– Bệnh nhân suy thận, dữ liệu từ nghiên cứu có đối chứng với giả dược kéo dài 52 tuần.
Tính an toàn và hiệu quả của empagliflozin kết hợp điều trị sẵn có với thuốc chống đái tháo đường được đánh giá ở những bệnh nhân suy thận nhẹ đến vừa trong một nghiên cứu mù đôi, có đối chứng với giả dược kéo dài 52 tuần.
Điều trị với JARDIANCE dẫn đến giảm HbA1c có ý nghĩa thống kê và cải thiện có ý nghĩa lâm sàng FPG (nồng độ đường huyết lúc đói), trọng lượng cơ thể và huyết áp so với giả dược ở tuần 24 (Bảng 15). Cải thiện HbA1c, FPG, trọng lượng cơ thể và huyết áp được duy trì cho đến 52 tuần.
| Bảng 15. Kết quả nghiên cứu kéo dài 24 tuần (LOCF) có đối chứng với giả dược dùng JARDIANCE ở bệnh nhân suy thận đái tháo đường typ 2 (Bộ phân tích đầy đủ) | |||||
Giả dược | Empagliflozin 10mg | Empagliflozin 25mg | Giả dược | Empagliflozin 25mg | |
eGFR ≥60 đến <90 mL/phút/1,73 m² | eGFR ≥30 đến <60 mL/phút/1,73 m² | ||||
N | 95 | 98 | 97 | 187 | 187 |
HbA1c (%) | |||||
Giá trị ban đầu (trung bình) | 8,09 | 8,02 | 7,96 | 8,04 | 8,03 |
Thay đổi so với ban đầu1 | 0,06 | -0,46 | -0,63 | 0,05 | -0,37 |
Khác biệt so với giả dược1 (KTC 95%) | -0,52* (-0,72, -0,32) | -0,68* (-0,88, -0,49) | -0,42* (-0,56, -0,28) | ||
N | 89 | 94 | 91 | 178 | 175 |
Bệnh nhân (%) đạt được HbA1c <7% với giá trị HbA1c ban đầu ≥7%2 | 6,7 | 17,0 | 24,2 | 7,9 | 12,0 |
N | 95 | 98 | 97 | 187 | 187 |
FPG (mg/dl) [mmol/l] | |||||
Giá trị ban đầu (trung bình) | 144,78 [8,04] | 145,96 [8,10] | 148,44 [8,24] | 153,4 [7,98] | 134,0 [7,92] |
Thay đổi so với ban đầu1 | 5,67 [0,31] | -13,88 [-0,77] | -18,08 [-1,00] | 10,2 [0,56] | -9,3 [-0,51] |
Khác biệt so với giả dược1 (KTC 95%) | -19,56 (-29,23, -9,88) [-1,09(-1,62, -0,55)] | -23,75 (-33,5, -14,03) [-1,32(-1,86, -0,78)] | -19,4* (-27,2, -11,6) [-11,08(-1,51, -0,64)] | ||
N | 95 | 98 | 97 | 187 | 187 |
Trọng lượng cơ thể (kg)2 | |||||
Giá trị ban đầu (trung bình) | 86,00 | 92,05 | 88,06 | 82,49 | 83,22 |
Thay đổi so với ban đầu1 | -0,33 | -1,76 | -2,33 | -0,08 | -0,98 |
Khác biệt so với giả dược1 (KTC 95%) | -1,43 (-2,09, -0,77) | -2,00 (-2,66, -1,34) | -0,91 (-1,41, -0,41) | ||
N | 95 | 98 | 97 | 187 | 187 |
SBP (mmHg)2 | |||||
Giá trị ban đầu (trung bình) | 134,69 | 137,37 | 133,68 | 136,38 | 136,64 |
Thay đổi so với ban đầu1 | 0,65 | -2,92 | -4,47 | 0,40 | -3,88 |
Khác biệt so với giả dược1 (KTC 95%) | -3,57 (-6,86, -0,29) | -5,12 (-8,41, -1,82) | -4,28 (-6,88, -1,68) | ||
1 trung bình đã hiệu chỉnh giá trị ban đầu và phân tầng. 2 Không được đánh giá để kiểm định ý nghĩa thống kê, không phải là một phần của quá trình kiểm định tuần tự cho tiêu chí phụ. * p<0,0001 | |||||
Nồng độ đường 2 giờ sau khi ăn
Điều trị với empagliflozin (10mg hoặc 25mg) kết hợp metformin hoặc metformin và sulfonylurea dẫn đến cải thiện có ý nghĩa trên lâm sàng nồng độ đường 2 giờ sau khi ăn (xét nghiệm dung nạp đường sau ăn) sau 24 tuần (điều trị kết hợp với metformin, tăng 5,9mg/dL ở nhóm dùng giả dược (n=57), giảm 46,0mg/dL ở nhóm dùng empagliflozin 10mg (n=52); giảm 44,6mg/dL ở nhóm dùng empagliflozin 25mg (n=58); bổ sung vào điều trị metformin và sulphonylurea, giảm 2,3mg/dL ở nhóm dùng giả dược (n=35), giảm 35,7mg/dL ở nhóm dùng empagliflozin 10mg (n=44) và giảm 36,6mg/dL ở nhóm dùng empagliflozin 25mg (n=46).
Bệnh nhân có HbA1c cao ở thời điểm ban đầu > 10%
Trong một phân tích gộp đã được định trước cho 3 nghiên cứu , điều trị với empagliflozin nhãn mở ở những bệnh nhân tăng đường huyết nghiêm trọng (N=184, giá trị HbA1c trung bình tại thời điểm ban đầu là 11,15%) dẫn đến giảm HbA1c có ý nghĩa lâm sàng so với thời điểm ban đầu (giảm 3,27%) ở tuần 24.
Trọng lượng cơ thể
Trong một phân tích gộp đã được định trước cho 4 nghiên cứu có đối chứng với giả dược, điều trị với empagliflozin dẫn đến giảm trọng lượng cơ thể so với giả dược ở tuần thứ 24 (giảm 2,04 kg ở nhóm dùng empagliflozin 10mg, giảm 2,26 kg ở nhóm dùng empagliflozin 25mg và giảm 0,16 kg ở nhóm dùng giả dược).
Huyết áp
Tính an toàn và hiệu quả của empagliflozin (10mg hoặc 25mg) đã được đánh giá trong một nghiên cứu mù đôi, có đối chứng với giả dược kéo dài 12 tuần ở những bệnh nhân đái tháo đường typ 2 và tăng huyết áp đang sử dụng thuốc chống đái tháo đường khác và với tối đa 2 loại thuốc chống tăng huyết áp (Bảng 16). Điều trị với empagliflozin một lần mỗi ngày dẫn đến cải thiện HbA1c có ý nghĩa thống kê, huyết áp tâm thu và tâm trương 24 giờ khi xác định bằng thiết bị đo huyết áp tự động. Điều trị với empagliflozin làm giảm huyết áp tâm thu ở tư thế ngồi (thay đổi so với thời điểm ban đầu, giảm 0,67mmHg khi dùng giả dược, giảm 4,60mmHg khi dùng empagliflozin 10mg và giảm 5,47mmHg khi dùng empagliflozin 25mg) và huyết áp tâm trương ở tư thế ngồi (thay đổi so với thời điểm ban đầu, giảm 1,13mmHg khi dùng giả dược, giảm 3,06mmHg khi dùng empagliflozin 10mg và giảm 3,02mmHg khi dùng empagliflozin 25mg).
| Bảng 16. Kết quả nghiên cứu kéo dài 12 tuần điều trị (LOCF) có đối chứng với giả dược dùng JARDIANCE ở những bệnh nhân đái tháo đường typ 2 và không kiểm soát được huyết áp (Bộ phân tích đầy đủ). | |||
Giả dược | Empagliflozin 10mg | Empagliflozin 25mg | |
N | 271 | 276 | 276 |
HbA1c (%) ở tuần 12 | |||
Giá trị ban đầu (trung bình) | 7,90 | 7,87 | 7,92 |
Thay đổi so với ban đầu1 | 0,03 | -0,59 | -0,62 |
Khác biệt so với giả dược1 (KTC 97,5%) | -0,62* (-0,72, -0,52) | -0,65* (-0,75, -0,55) | |
Huyết áp tâm thu 24 giờ ở tuần 122 | |||
Giá trị ban đầu (trung bình) | 131,72 | 131,34 | 131,18 |
Thay đổi so với ban đầu1 | 0,48 | -2,95 | -3,68 |
Khác biệt so với giả dược1 (KTC 97,5%) | -3,44* (-4,78, -2,09) | -4,16* (-5,50, -2,83) | |
Huyết áp tâm trương 24 giờ ở tuần 122 | |||
Giá trị ban đầu (trung bình) | 75,16 | 75,13 | 74,64 |
Thay đổi so với ban đầu1 | 0,32 | -1,04 | -1,40 |
Khác biệt so với giả dược1 (KTC 97,5%) | -1,36** (-2,15, -0,56) | -1,72* (-2,51, -0,93) | |
1 Trung bình được hiệu chỉnh theo giá trị ban đầu và phân tầng. 2 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy chống tăng huyết áp) được sử dụng trở về sau (LOCF) 3 Giá trị lần quan sát cuối cùng (trước khi được điều trị cứu nguy đường huyết) được sử dụng trở về sau (LOCF). * Giá trị p <0,0001. ** Giá trị p =0,0008. | |||
Trong một phân tích gộp đã định trước cho 4 nghiên cứu có đối chứng với giả dược, điều trị với empagliflozin dẫn đến giảm huyết áp tâm thu (empagliflozin 10mg làm giảm 3,9mmHg, empagliflozin 25mg giảm 4,3mmHg) so với giả dược (giảm 0,5mmHg) và giảm huyết áp tâm trương (empagliflozin 10mg giảm 1,8mmHg, empagliflozin 25mg giảm 2,0mmHg) so với giả dược (giảm 0,5mmHg) ở tuần thứ 24 và duy trì cho đến tuần thứ 52.
– Các kết quả xét nghiệm
Tăng Hematocrit
Kết quả của phân tích gộp về tính an toàn (gộp tất cả bệnh nhân mắc đái tháo đường, n=13 402) cho thấy giá trị hematocrit thay đổi trung bình là 3,4% và 3,6% tương ứng ở nhóm sử dụng empagliflozin 10mg và 25mg so với giá trị ban đầu, trong khi đó ở nhóm sử dụng giả dược giá trị này là -0,1%. Trong nghiên cứu EMPA-REG OUTCOME®, giá trị hematocrit trở về ban đầu sau khoảng 30 ngày sau khi ngừng điều trị.
Tăng lipid máu
Kết quả của phân tích gộp về tính an toàn (gộp tất cả bệnh nhân mắc đái tháo đường, n=13 402) cho thấy ở nhóm sử dụng empagliflozin 10mg và 25mg, giá trị cholesterol toàn phần tăng tương ứng 4,9% và 5,7% so với nhóm chứng là 3,5%, giá trị HDL-cholesterol tăng tương ứng 3,3% và 3,6% so với nhóm chứng là 0,4%, giá trị LDL-cholesterol tăng 9,5% và 10,0 % so với nhóm chứng là 7,5%, giá trị triglycerid tăng 9,2% và 9,9% so với ở nhóm chứng là 10,5%.
Tác dụng trên tim mạch
Nghiên cứu EMPA-REG OUTCOME® là thử nghiệm lâm sàng đa trung tâm, đa quốc gia, ngẫu nhiên, mù đôi có đối chứng đánh giá tác dụng của Jardiance với vai trò bổ trợ cho điều trị chuẩn trong việc làm giảm biến cố tim mạch ở bệnh nhân đái tháo đường type 2 và có một hoặc nhiều yếu tố nguy cơ tim mạch, bao gồm bệnh mạch vành, bệnh mạch ngoại vi, tiền sử nhồi máu cơ tim hoặc tiền sử đột quỵ. Tiêu chí chính của nghiên cứu là thời gian xuất hiện đầu tiên của một trong các biến cố: Tử vong do bệnh tim mạch, nhồi máu cơ tim không tử vong hoặc đột quỵ không tử vong (Biến cố Tim mạch chính (MACE-3)). Các tiêu chí bổ sung là các tiêu chí có ý nghĩa lâm sàng bao gồm: tử vong do bệnh tim mạch, tiêu chí gộp của nhập viện do suy tim hoặc tử vong do bệnh tim mạch, tử vong do mọi nguyên nhân và tiêu chí gộp của bệnh thận mới hoặc tiến triển.
Tổng số 7020 bệnh nhân được điều trị bằng Jardiance (Empagliflozin 10mg: 2345, empagliflozin 25mg: 2342, placebo: 2333) và theo dõi trong thời gian có trung vị là 3,1 năm. Quần thể bệnh nhân nghiên cứu gồm 72,4% người da trắng, 21,6% người châu Á và 5,1% người da đen. Độ tuổi trung bình là 63 và 72,4% bệnh nhân là nam giới. Tại thời điểm ban đầu, xấp xỉ 81% bệnh nhân được điều trị bằng thuốc ức chế hệ renin-angiotensin, 65% điều trị bằng thuốc chẹn beta, 43% sử dụng thuốc lợi tiểu, 89% sử dụng thuốc chống đông và 81% sử dụng thuốc hạ lipid máu. Khoảng 74% bệnh nhân được sử dụng metformin, 48% sử dụng insulin và 43% sử dụng các sulfonylure.
Khoảng một nửa số bệnh nhân (52,2%) có eGFR trong khoảng 60-90 ml/phút/1,73m2, 17,8% trong khoảng 45-60 ml/phút/1,73m2 và 7,7% trong khoảng 30-45 ml/phút/1,73m2. Giá trị trung bình của huyết áp tâm thu là 136mmHg, huyết áp tâm trương là 76mmHg, LDL 86mg, HDL 44mg/dL và tỷ số albumin niệu/creatinin (UARC) là 175mg/g tại thời điểm ban đầu.
Mức độ giảm nguy cơ tử vong do bệnh tim mạch và tử vong do mọi nguyên nhân
Jardiance vượt trội trong làm giảm tiêu chí chính, là tiêu chí gộp của tử vong, nhồi máu cơ tim không tử vong và đột quỵ không tử vong so với placebo. Thuốc làm giảm có ý nghĩa thống kê tỷ lệ tử vong do bệnh tim mạch, nhưng ít thay đổi nguy cơ nhồi máu cơ tim không tử vong và nguy cơ đột quỵ không tử vong (Bảng 17 và Hình 1).
Jardiance cũng đồng thời cải thiện thời gian sống thêm (Bảng 17 và Hình 2), do làm giảm tỷ lệ tử vong do bệnh tim mạch. Không có sự khác biệt có ý nghĩa thống kê giữa empagliflozin và placebo trong việc làm giảm tỷ lệ tử vong do các bệnh khác.
| Bảng 17. Tác dụng điều trị của thuốc xét theo tiêu chí gộp chính, các hợp phần và tỷ lệ tử vong (Toàn thể bệnh nhân điều trị*) | ||
Giả dược | Empagliflozin (gộp chung 10mg và 25mg) | |
N | 2333 | 4687 |
Thời gian xuất hiện lần đầu tiên một trong các biến cố: Tử vong do bệnh tim mạch, nhồi máu cơ tim không tử vong, hay đột quỵ không tử vong N (%) | 282 (12,1) | 490 (10,5) |
Tỷ số nguy cơ so với giả dược (KTC 95,02%)** | 0,86 (0,74; 0,99) | |
Giá trị p cho mức độ vượt trội | 0,0382 | |
Tử vong do bệnh tim mạch N (%) | 137 (5,9) | 172 (3,7) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,62 (0,49; 0,77) | |
Giá trị p | <0,0001 | |
Nhồi máu cơ tim không tử vong N (%) | 121 (5,2) | 213 (4,5) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,87 (0,70; 1,09) | |
Giá trị p | 0,2189 | |
Đột quỵ không tử vong N (%) | 60 (2,6) | 150 (3,2) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 1,24 (0,92; 1,67) | |
Giá trị p | 0,1638 | |
Tử vong do mọi nguyên nhân N (%) | 194 (8,3) | 269 (5,7) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,68 (0,57; 0,82) | |
Giá trị p | <0,0001 | |
Tử vong không do tim mạch N(%) | 57 (2,4) | 97 (2,1) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,84 (0,60; 1,16) | |
* Nghĩa là bệnh nhân sử dụng tối thiểu một liều thuốc nghiên cứu ** Vì dữ liệu trong thử nghiệm nằm trong một phân tích tạm thời, khoảng tin cậy 2 phía 95,02% được sử dụng với mức ý nghĩa tương ứng là 0,0498. | ||
Hình 1. Thời gian đến khi xảy ra biến cố tử vong do bệnh tim mạch
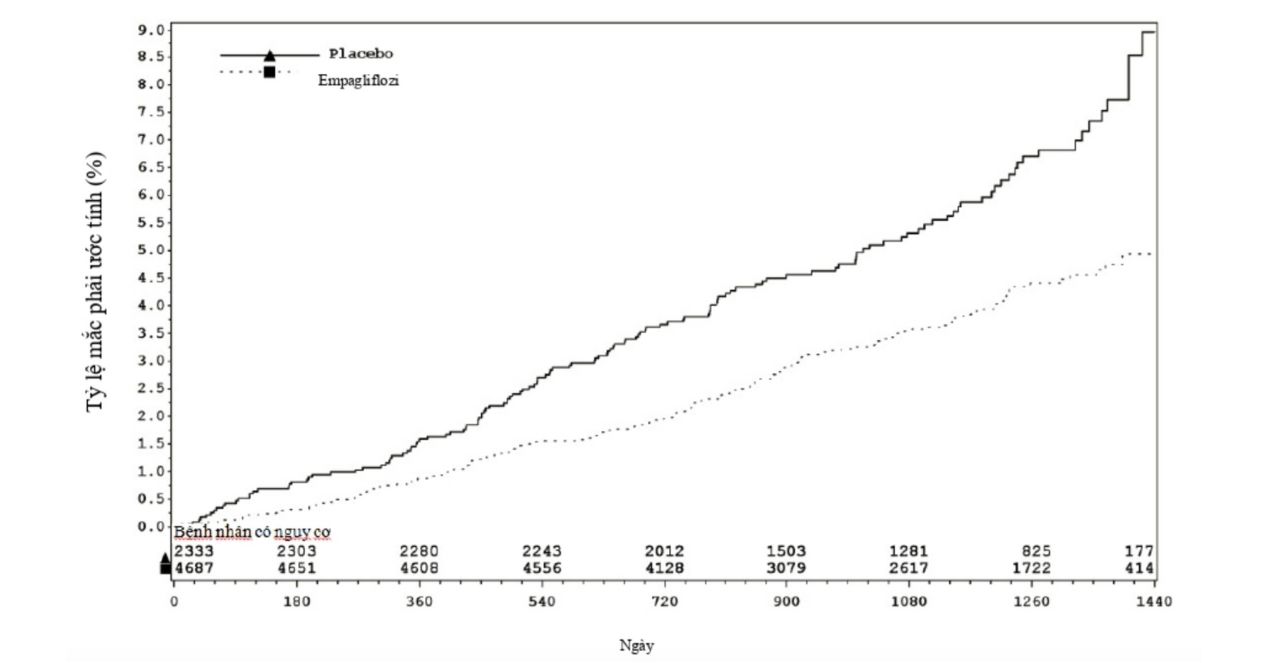
Hình 2. Thời gian đến khi xảy ra biến cố tử vong do mọi nguyên nhân*

* Ước tính Kaplan-Meier thời gian xảy ra biến cố tử vong do mọi nguyên nhân, toàn bộ bệnh nhân sử dụng empagliflozin so với giả dược.
Giảm nguy cơ suy tim cần nhập viện hoặc tử vong do bệnh tim mạch
Jardiance làm giảm rõ rệt nguy cơ nhập viện do suy tim và tử vong do bệnh tim mạch hoặc nhập viện do suy tim so với giả dược (Bảng 18 và Hình 3).
| Bảng 18. Hiệu quả của thuốc thể hiện qua tỷ lệ nhập viện do suy tim hoặc tử vong do bệnh tim mạch (loại trừ đột quỵ dẫn đến tử vong) (Toàn thể bệnh nhân được điều trị*) | ||
Giả dược | Empagliflozin** (gộp chung 10 và 25mg) | |
N | 2333 | 4687 |
Suy tim cần nhập viện hoặc tử vong do bệnh tim mạch (loại trừ đột quỵ dẫn đến tử vong) N (%)*** | 198 (8,5) | 265 (5,7) |
Tỷ số nguy cơ (KTC 95%) | 0,66 (0,55; 0,79) | |
Giá trị p | <0,0001 | |
Suy tim cần nhập viện N (%) | 95 (4,1) | 126 (2,7) |
Tỷ số nguy cơ (KTC 95%) | 0,65 (0,50; 0,85) | |
Giá trị p | 0,0017 | |
Tử vong do bệnh tim mạch (loại trừ đột quỵ dẫn đến tử vong) N (%) | 126 (5,4) | 156 (3,3) |
Tỷ số nguy cơ (KTC 95%) | 0,61 (0,48; 0,77) | |
Giá trị p | < 0,0001 | |
* Bệnh nhân sử dụng ít nhất một liều thuốc nghiên cứu. ** empagliflozin 10mg và 25mg cho kết quả tương đồng. *** Thời gian xảy ra biến cố lần đầu tiên. | ||
Hình 3. Thời gian đến khi xảy ra biến cố suy tim cần nhập viện hoặc tử vong do bệnh tim mạch đầu tiên*

* Hàm tỷ lệ mới mắc tích lũy ước tính đối với thời gian xuất hiện biến cố nhập viện do suy tim hoặc tử vong do bệnh tim mạch đầu tiên của nhóm gộp những bệnh nhân dùng empagliflozin so với nhóm dùng giả dược.
Lợi ích trên tim mạch của Jardiance ghi nhận thống nhất qua các phân tích dưới nhóm được thể hiện trong Hình 4.
Hình 4. Phân tích dưới nhóm cho tiêu chí tử vong do bệnh tim mạch và suy tim cần nhập viện hoặc tử vong do bệnh tim mạch*,**

* Nhập viện do suy tim hoặc tử vong do bệnh tim mạch, loại trừ tử vong do đột quỵ.
**Giá trị p dùng để kiểm định tính đồng nhất sự khác biệt giữa các nhóm trong phân tích dưới nhóm (kiểm định tính tương tác hiệp biến cho nhóm) mà không hiệu chỉnh cho kiểm định nhiều lần và có thể không thể hiện tác động của một yếu tố đặc biệt nào sau khi hiệu chỉnh cho tất cả các yếu tố khác. Tính đồng nhất hoặc không đồng nhất rõ ràng giữa các nhóm không nên bị phiên giải quá mức.
– Bệnh thận đái tháo đường
Trong quần thể nghiên cứu của thử nghiệm EMPA-REG OUTCOME®, nguy cơ xuất hiện bệnh thận mới mắc hoặc tiến triển (được định nghĩa là xuất hiện albumin niệu đại thể, creatinin huyết thanh tăng gấp đôi và bắt đầu sử dụng liệu pháp thay thế thận (lọc máu)) giảm một cách có ý nghĩa ở nhóm sử dụng empagliflozin so với giả dược (Bảng 19 và Hình 5).
Jardiance cho tỷ lệ bệnh nhân có albumin niệu đại thể tại thời điểm ban đầu trở thành albumin niệu vi thể hoặc albumin niệu bình thường cao hơn rõ rệt so với nhóm dùng giả dược (Tỷ số nguy cơ 1,82; KTC 95% 1,40; 2,37).
| Bảng 19. Thời gian đến khi xảy ra bệnh thận mới mắc hoặc tiến triển (Toàn bộ bệnh nhân được điều trị*) | ||
Giả dược | Empagliflozin (gộp chung 10 và 25mg) | |
N | 2061 | 4124 |
Bệnh thận mới mắc hoặc tiến triển, N (%) | 388 (18,8) | 525 (12,7) |
Tỷ số nguy cơ (KTC 95%) | 0,61 (0,53; 0,70) | |
Giá trị p | <0,0001 | |
N | 2323 | 4645 |
Nồng độ creatinin huyết thanh tăng gấp đôi**, N (%) | 60 (2,6) | 70 (1,5) |
Tỷ số nguy cơ (KTC 95%) | 0,56 (0,39; 0,79) | |
Giá trị p | 0,0009 | |
N | 2033 | 4091 |
Khởi phát mới albumin niệu đại thể mới*** N (%) | 330 (16,2) | 459 (11,2) |
Tỷ số nguy cơ (KTC 95%) | 0,62 (0,54; 0,72) | |
Giá trị p | <0,0001 | |
N | 2333 | 4687 |
Bắt đầu sử dụng liệu pháp thay thế thận liên tục, N (%) | 14 (0,6) | 13 (0,3) |
Tỷ số nguy cơ (KTC 95%) | 0,45 (0,21; 0,97) | |
Giá trị p | 0,0409 | |
N | 2333 | 4687 |
Tử vong do bệnh thận, N (%)**** | 0 | 3 (0,1) |
* Bệnh nhân dùng tối thiểu một liều thuốc nghiên cứu. ** Đi kèm với eGFR ≤45 mL/phút/1.73m2. *** Tỷ số albumin niệu/creatinin >300mg/g. **** Do tỷ lệ xảy ra biến cố thấp nên không tính được tỷ số nguy cơ. | ||
Hình 5. Thời gian đến khi xảy ra bệnh thận mới mắc hoặc tiến triển
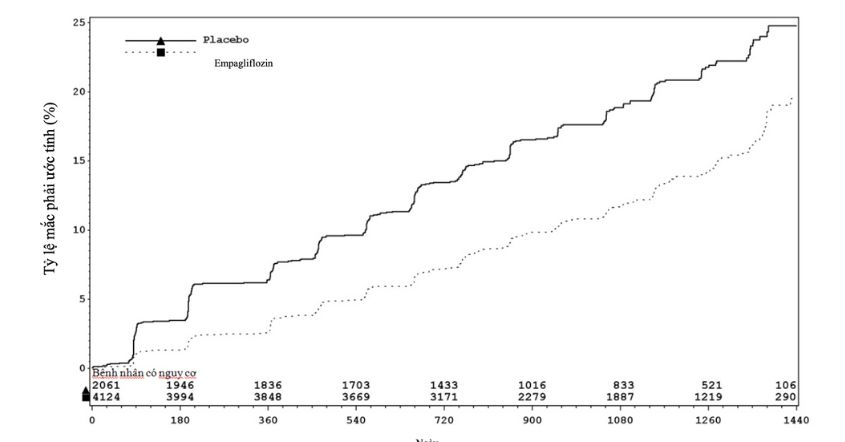
Nhóm được điều trị bằng empagliflozin có eGFR bảo tồn và eGFR tăng trong 4 tuần theo dõi sau khi ngừng điều trị. Tuy nhiên, nhóm sử dụng giả dược có eGFR giảm dần trong quá trình nghiên cứu và không thay đổi trong 4 tuần theo dõi sau khi ngừng điều trị.
Hình 6. eGFR theo thời gian*
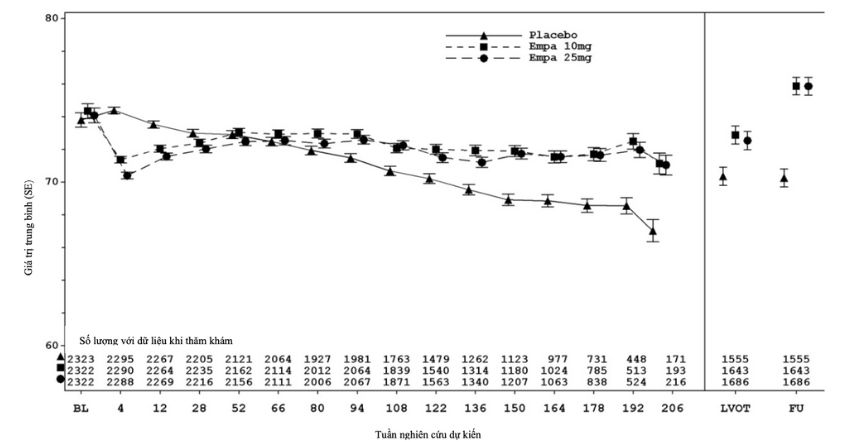
* Kết quả eGFR (MDRD) (mL/min/1.73m2) MMRM theo thời gian, giá trị cuối đợt điều trị chưa hiệu chỉnh và giá trị trong thời gian theo dõi – toàn bộ bệnh nhân được điều trị – phần bên phải dựa trên những bệnh nhân có giá trị cuối đợt điều trị (LVOT) và trong thời gian theo dõi (FU).
Nghiên cứu QTc
Trong một nghiên cứu chéo đôi ngẫu nhiên, có đối chứng giả dược và so sánh với chất có hoạt tính trên 30 đối tượng nghiên cứu khỏe mạnh, cả mức liều 25mg và 200mg empagliflozin đều không làm tăng QTc.
Suy tim
Empagliflozin trên bệnh nhân suy tim với phân suất tống máu thất trái giảm
Một nghiên cứu ngẫu nhiên, mù đôi, có đối chứng (EMPEROR-Reduced) đã được tiến hành trên 3730 bệnh nhân suy tim mạn tính (độ II-IV theo phân loại của Hiệp Hội Tim New York (New York Heart Association) [NYHA]) và phân suất tống máu thất trái giảm (LVEF ≤ 40 %) nhằm đánh giá tính an toàn và hiệu quả của empagliflozin 10mg, dùng 1 lần/ngày thêm vào liệu pháp chuẩn điều trị suy tim. Tiêu chí chính của nghiên cứu là thời gian xuất hiện lần đầu của một trong hai biến cố được thẩm định là tử vong do bệnh tim mạch hoặc nhập viện do suy tim.
Tần suất của biến cố được thẩm định là nhập viện do suy tim (lần đầu và tái nhập viện) và độ dốc đường biểu diễn sự thay đổi của eGFR (CKD-EPI)cr so với thời điểm ban đầu trong phép kiểm khẳng định kết quả. Các thuốc điều trị suy tim được sử dụng ở thời điểm ban đầu bao gồm thuốc ức chế men chuyển/ thuốc chẹn thụ thể angiotensin/ thuốc ức chế kép thụ thể angiotensin – neprilysin (88,3%), thuốc chẹn beta (94,7%), thuốc đối kháng thụ thể mineralocorticoid (71,3%) và thuốc lợi tiểu (95,0%).
Tổng cộng 1863 bệnh nhân đã được chọn ngẫu nhiên để dùng empagliflozin 10mg (nhóm giả dược: 1867 bệnh nhân) và theo dõi trong thời gian trung vị là 15,7 tháng. Dân số nghiên cứu bao gồm 76,1% nam giới và 23,9% nữ giới ở độ tuổi trung bình 66,8 tuổi (từ 25-94 tuổi), 26,8% bằng hoặc trên 75 tuổi. 70,5% dân số nghiên cứu là người da trắng, 18,0% là người Châu Á và 6,9% là người châu Phi/ người Mỹ gốc Phi. Tại thời điểm phân ngẫu nhiên, có 75,1% bệnh nhân suy tim độ II, 24,4% bệnh nhân suy tim độ III và 0,5% bệnh nhân suy tim độ IV theo phân loại của NYHA. LVEF trung bình là 27,5%. Tại thời điểm ban đầu, eGFR trung bình là 62,0 mL/phút/1,73 m2 và tỷ lệ albumin/creatinine (urinary albumin to creatinine ratio – UACR) trung vị là 22mg/g. Khoảng một nửa số bệnh nhân (51,7%) có eGFR ≥ 60 mL/phút/1,73m2, 24,1% bệnh nhân có eGFR từ 45 đến <60 mL/phút/1,73 m2, 18,6% bệnh nhân có eGFR từ 30 đến < 45 mL/ phút /1,73m2 và 5,3% bệnh nhân có eGFR từ 20 đến < 30 mL/ phút /1,73 m2 .
Empagliflozin vượt trội so với giả dược trong việc giảm nguy cơ của tiêu chí gộp chính bao gồm tử vong do bệnh tim mạch hoặc nhập viện do suy tim. Hơn nữa, empagliflozin giảm có ý nghĩa nguy cơ xuất hiện biến cố nhập viện do suy tim (lần đầu và tái nhập viện), và giảm có ý nghĩa tỷ lệ giảm eGFR (xem bảng 20).
| Bảng 20. Hiệu quả điều trị trên tiêu chí gộp chính, các tiêu chí thành phần của tiêu chí gộp chính và hai tiêu chí phụ quan trọng được bao gồm trong phép kiểm khẳng định kết quả đã được xác định trước. | ||
Giả dược | Empagliflozin 10mg | |
N | 1867 | 1863 |
Thời gian xuất hiện lần đầu tiên một trong hai biến cố: Tử vong do bệnh tim mạch, hay nhập viện do suy tim, N (%) | 462 (24,7) | 361 (19,4) |
Tỷ số nguy cơ so với giả dược (KTC 95,04%)** | 0,75 (0,65; 0,86) | |
Giá trị p cho mức độ vượt trội | <0,0001 | |
Tử vong do bệnh tim mạch, N (%)* | 202 (10,8) | 187 (10,0) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,92 (0,75; 1,12) | |
Giá trị p | 0,4113 | |
Nhập viện do suy tim (xuất hiện lần đầu), N (%)* | 342 (18,3) | 246 (13,2) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,69 (0,59; 0,81) | |
Giá trị p | <0,0001 | |
Nhập viện do suy tim (lần đầu và tái nhập viện), N của các biến cố | 553 | 388 |
Tỷ số nguy cơ so với giả dược (KTC 95,04%)** | 0,70 (0,58; 0,85) | |
Giá trị p | 0,0003 | |
Độ dốc đường biểu diễn eGFR (CKD EPI)cr, tỷ lệ giảm (ml/phút/1,73m2/năm ) | -2,28 | -0,55 |
Sự khác biệt giữa điều trị và giả dược (KTC 99,9%)*** | 1,73 (0,67; 2,80 ) | |
Giá trị p | p < 0,0001 | |
eGFR = Estimated glomerular filtration rate (Độ lọc cầu thận ước tính). CKD EPI = Chronic kidney disease epidemiology collaboration equation (phương trình CKD EPI). * Không được kiểm soát với lỗi loại 1. **Do một phân tích tạm thời, khoảng tin cậy 2 phía 95,04% đã được áp dụng tương ứng với giá trị p < 0,0496 cho biến cố tử vong do bệnh tim mạch và nhập viện do suy tim được thẩm định bởi một hội đồng biến cố lâm sàng độc lập và phân tích dựa trên toàn bộ bệnh nhân được lựa chọn ngẫu nhiên. ***được định trước trong quá trình kiểm tra xác suất, khoảng tin cậy 2 phía 99,9% được áp dụng tương ứng với giá trị p< 0,001 cho độ dốc rõ rệt của đường biểu diễn eGFR được phân tích dựa vào toàn bộ bệnh nhân được điều trị. | ||
Hình 7. Thời gian đến khi xảy ra lần đầu một trong hai biến cố được thẩm định là tử vong do bệnh tim mạch hoặc nhập viện do suy tim
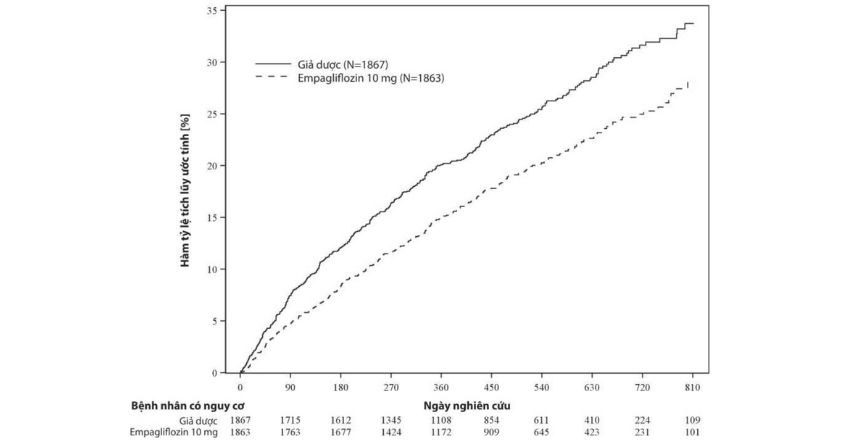
Hình 8. Thời gian đến khi xảy ra biến cố nhập viện do suy tim được thẩm định

Các kết quả của tiêu chí gộp chính nhìn chung nhất quán với tỷ số nguy hại (HR) dưới 1 trong các phân nhóm đã được xác định trước, bao gồm bệnh nhân suy tim mắc hoặc không mắc đái tháo đường týp 2 (Xem Hình 9).
Hình 9. Các phân tích dưới nhóm về thời gian đến khi xảy ra lần đầu một trong hai biến cố được thẩm định là tử vong do bệnh tim mạch hoặc nhập viện do suy tim
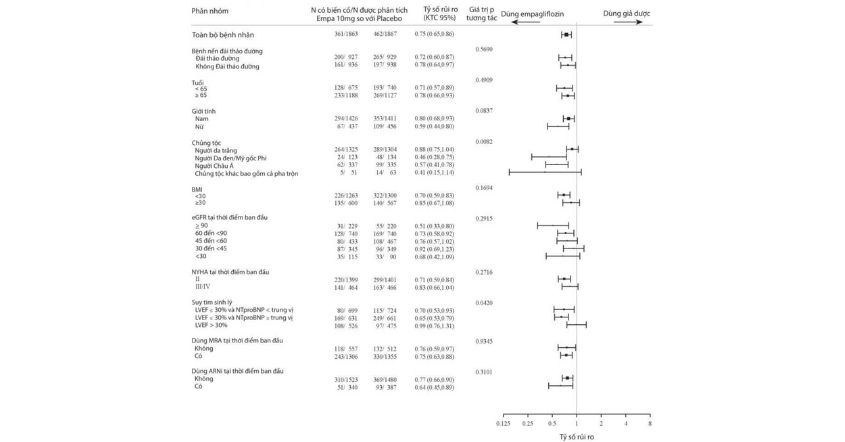
LVEF > 30%: bao gồm cả bệnh nhân trên và dưới mức trung vị của NTproBNP. Để được lựa chọn, bệnh nhân có LVEF > 30% yêu cầu đạt ngưỡng NTproBNP cao hơn những bệnh nhân có LVEF ≤ 30%, trừ trường hợp họ có thêm bệnh sử nhập viện do suy tim trong vòng 12 tháng gần đây.
Kết cục trên thận
Trong thời gian điều trị, mức giảm eGFR theo thời gian chậm hơn ở nhóm bệnh nhân dùng empagliflozin so với nhóm dùng giả dược (xem Hình 10). Điều trị với empagliflozin 10mg làm giảm có ý nghĩa tỷ lệ suy giảm eGFR và hiệu quả này nhất quán trong tất cả các phân nhóm đã được xác định trước (xem Bảng 20). Bệnh nhân điều trị với empagliflozin có giảm eGFR lúc bắt đầu điều trị nhưng sau đó trở về mức ban đầu sau khi ngừng điều trị, điều này cho thấy sự thay đổi huyết động học đóng vai trò trong các ảnh hưởng tức thời của empagliflozin trên eGFR.
Hình 10. Thay đổi eGFR theo thời gian *

*eGFR (CKD-EPI) (mL/phút/1,73m2) các kết quả MMRM theo thời gian – toàn bộ bệnh nhân được chia nhóm ngẫu nhiên. Số lượng bệnh nhân cung cấp số liệu tại các thời điểm khác nhau (giả dược, empagliflozin): ở tuần 4 (1788, 1802); ở tuần 12 (1729, 1756); ở tuần 32 (1563, 1614); ở tuần 52 (1211, 1228); ở tuần 76 (801, 805); ở tuần 100 (359, 386); và ở tuần 124 (86, 91).
JARDIANCE làm giảm nguy cơ của tiêu chí gộp trên thận, được định nghĩa là thời gian đến khi xảy ra lần đầu một trong các biến cố sau: lọc thận mạn tính, ghép thận hoặc giảm eGFR kéo dài so với giả dược (Bảng 21 và Hình 11).
| Bảng 21. Thời gian đến khi xảy ra biến cố của tiêu chí gộp trên thận và các tiêu chí thành phần | ||
Giả dược | Empagliflozin (10mg) | |
N | 1867 | 1863 |
Số lượng bệnh nhân có các biến cố của tiêu chí gộp trên thận , N (%) | 58 (3,1) | 30 (1,6) |
HR (95% CI) | 0,50 (0,32; 0,77) | |
Giá trị p danh định | 0,0019 | |
Biến cố đầu tiên là giảm eGFR ≥40% kéo dài N (%) | 50 (2,7) | 27 (1,4) |
Biến cố đầu tiên là eGFR <15 kéo dài (thời điểm ban đầu ≥30) hoặc <10 (thời điểm ban đầu <30) [mL/phút/1,73 m2], N (%) | 0 | 0 |
Biến cố đầu tiên là lọc thận mạn tính, N (%) | 8 (0,4) | 3 (0,2) |
Biến cố đầu tiên là ghép thận, N (%) | 0 | 0 |
Tiêu chí gộp trên thận được xác định là lọc thận mạn tính hoặc ghép thận hoặc giảm kéo dài eGFR> 40% (CKD−EPI)cr hoặc eGFR (CKD−EPI)cr ở mức < 15 mL/phút/1,73 m² kéo dài (< 10 mL/ phút /1,73 m² ở bệnh nhân có eGFR (CKD−EPI)cr < 30mL/ phút /1,73 m² tại thời điểm ban đầu). Lọc thận được coi là mạn tính nếu tần suất lọc thận ≥ 2 lần/ tuần trong ít nhất 90 ngày. Giảm eGFR (CKD−EPI)cr được coi là kéo dài nếu được xác định bởi hai hay nhiều hơn hai lần đo liên tiếp sau khi đo lần đầu tại phòng thí nghiệm trung tâm, cách nhau ít nhất 30 ngày (từ giá trị đầu tiên tới cuối cùng trong các giá trị eGFR liên tiếp). Nếu không có số liệu đo thêm sau hơn 30 ngày sau khi quan sát thấy eGFR giảm và bệnh nhân tử vong trong vòng 60 ngày trong khoảng thời gian lượng giá thì việc giảm eGFR cũng được coi là kéo dài. | ||
Hình 11. Thời gian đến khi xảy ra lần đầu biến cố của tiêu chí gộp trên thận
Hiệu quả của empagliflozin trên các triệu chứng suy tim tại tuần 52 đã được đánh giá bởi kết quả do bệnh nhân báo cáo sử dụng sự thay đổi điểm lâm sàng tóm lược KCCQ (Kansas City Cardiomyopathy Questionnaire) so với thời điểm ban đầu, dùng để đo trung bình tần suất các triệu chứng và gánh nặng đối với phù, mệt mỏi, thở gấp và những hạn chế về thể chất.
Ở nhóm bệnh nhân dùng empagliflozin, có sự cải thiện tốt hơn điểm lâm sàng tóm lược tại tuần 52 so với thời điểm ban đầu so với nhóm dùng giả dược (thay đổi trung bình so với thời điểm ban đầu được hiệu chỉnh ở nhóm dùng giả dược đã được hiệu chỉnh là 1,75, KTC 95%, CI 0,51 đến 2,99, giá trị p danh định = 0,0058), do tất cả các yếu tố cấu thành (tần suất triệu chứng, gánh nặng triệu chứng và những hạn chế về thể chất).
Empagliflozin trên bệnh nhân suy tim với phân suất tống máu thất trái bảo tồn
Một nghiên cứu ngẫu nhiên, mù đôi, có đối chứng (EMPEROR-Preserved) đã được tiến hành trên 5988 bệnh nhân suy tim mạn tính (độ II-IV theo phân loại của Hiệp Hội Tim New York (New York Heart Association) [NYHA]) và có phân suất tống máu thất trái bảo tồn (LVEF > 40 %) nhằm đánh giá tính an toàn và hiệu quả của empagliflozin 10mg, dùng 1 lần/ngày thêm vào liệu pháp điều trị chuẩn. Tiêu chí chính của nghiên cứu là thời gian xuất hiện lần đầu của một trong hai biến cố được thẩm định là tử vong do bệnh tim mạch hoặc nhập viện do suy tim. Tần suất của biến cố được thẩm định là nhập viện do suy tim (lần đầu và tái nhập viện) và độ dốc đường biểu diễn sự thay đổi của eGFR (CKD-EPI)cr so với thời điểm ban đầu trong phép kiểm khẳng định kết quả. Các thuốc điều trị suy tim được sử dụng ở thời điểm ban đầu bao gồm thuốc ức chế men chuyển/ thuốc chẹn thụ thể angiotensin/ thuốc ức chế kép thụ thể angiotensin – neprilysin (80,7%), thuốc chẹn beta (86,3%), thuốc đối kháng thụ thể mineralocorticoid (37,5%) và thuốc lợi tiểu (86,2%).
Tổng cộng 2997 bệnh nhân đã được chọn ngẫu nhiên để dùng empagliflozin 10mg (nhóm giả dược: 2991 bệnh nhân) và theo dõi trong thời gian trung vị là 26,2 tháng. Dân số nghiên cứu bao gồm 55,3% nam giới và 44,7% nữ giới ở độ tuổi trung bình 71,9 tuổi (từ 22-100 tuổi), 43,0% bằng hoặc trên 75 tuổi. 75,9% dân số nghiên cứu là người da trắng, 13,8% là người Châu Á và 4,3% là người châu Phi/ người Mỹ gốc Phi. Tại thời điểm phân ngẫu nhiên, có 81,5% bệnh nhân suy tim độ II, 18,1% bệnh nhân suy tim độ III và 0,3% bệnh nhân suy tim độ IV theo phân loại của NYHA. Quần thể nghiên cứu trong EMPEROR-Preserved bao gồm bệnh nhân có LVEF <50% (33,1%), từ 50 đến < 60% (34,4%) và LVEF ≥ 60% (32,5%). Tại thời điểm ban đầu, eGFR trung bình là 60,6 mL/phút/1,73 m2 và tỷ lệ albumin/creatinine (urinary albumin to creatinine ratio – UACR) trung vị là 21mg/g. Khoảng một nửa số bệnh nhân (50,1%) có eGFR ≥60 mL/phút/1,73 m2, 26,1% bệnh nhân có eGFR từ 45 đến <60 mL/phút/1,73 m2, 18,6% bệnh nhân có eGFR từ 30 đến <45 mL/ phút /1,73 m2 và 4,9% bệnh nhân có eGFR từ 20 đến <30 mL/ phút /1,73 m2.
Empagliflozin vượt trội so với giả dược trong việc giảm nguy cơ của tiêu chí gộp chính bao gồm tử vong do bệnh tim mạch hoặc nhập viện do suy tim. Hơn nữa, empagliflozin giảm có ý nghĩa nguy cơ xuất hiện biến cố nhập viện do suy tim (lần đầu và tái nhập viện), và giảm có ý nghĩa tỷ lệ giảm eGFR (xem bảng 22).
| Bảng 22. Hiệu quả điều trị trên tiêu chí gộp chính, các tiêu chí thành phần của tiêu chí gộp chính và hai tiêu chí phụ quan trọng được bao gồm trong phép kiểm khẳng định kết quả đã được xác định trước. | ||
Giả dược | Empagliflozin 10mg | |
N | 2991 | 2997 |
Thời gian xuất hiện lần đầu tiên một trong hai biến cố: Tử vong do bệnh tim mạch, hay nhập viện do suy tim, N (%) | 511 (17,1) | 415 (13,8) |
Tỷ số nguy cơ so với giả dược (KTC 95,03%)** | 0,79 (0,69; 0,90) | |
Giá trị p cho mức độ vượt trội | 0,0003 | |
Tử vong do bệnh tim mạch, N (%)* | 244 (8,2) | 219 (7,3) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,91 (0,76, 1,09) | |
Giá trị p | 0,2951 | |
Nhập viện do suy tim (xuất hiện lần đầu), N (%)* | 352 (11,8) | 259 (8,6) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,71 (0,60; 0,83) | |
Giá trị p | <0,0001 | |
Nhập viện do suy tim (lần đầu và tái nhập viện), N của các biến cố | 541 | 407 |
Tỷ số nguy cơ so với giả dược (KTC 95,03%)** | 0,73 (0,61; 0,88) | |
Giá trị p | 0,0009 | |
Độ dốc đường biểu diễn eGFR (CKD EPI)cr, tỷ lệ giảm (ml/phút/1,73m2/năm ) | −2,62 | −1,25 |
Sự khác biệt giữa điều trị và giả dược (KTC 99,9%)*** | 1,36 (0,86; 1,87) | |
Giá trị p | <0,0001 | |
eGFR = Estimated glomerular filtration rate (Độ lọc cầu thận ước tính). CKD EPI = Chronic kidney disease epidemiology collaboration equation (phương trình CKD EPI). * Không được kiểm soát với lỗi loại 1. **Do một phân tích tạm thời, khoảng tin cậy 2 phía 95,03% đã được áp dụng tương ứng với giá trị p < 0,0497 cho biến cố tử vong do bệnh tim mạch và nhập viện do suy tim được thẩm định bởi một hội đồng biến cố lâm sàng độc lập và phân tích dựa trên toàn bộ bệnh nhân được lựa chọn ngẫu nhiên. ***được định trước trong quá trình kiểm tra xác suất, khoảng tin cậy 2 phía 99,9% được áp dụng tương ứng với giá trị p< 0,001 cho độ dốc rõ rệt của đường biểu diễn eGFR được phân tích dựa vào toàn bộ bệnh nhân được điều trị. | ||
Hình 12. Thời gian đến khi xảy ra lần đầu một trong hai biến cố được thẩm định là tử vong do bệnh tim mạch hoặc nhập viện do suy tim
Hình 13. Thời gian đến khi xảy ra biến cố nhập viện do suy tim được thẩm định
Các kết quả của tiêu chí gộp chính nhất quán giữa các phân nhóm đã được xác định trước, phân loại bởi phân suất tống máu, tình trạng tiểu đường hoặc chức năng thận giảm tới mức eGFR 20 ml/min/1,73 m2 (Xem Hình 14).
Hình 14. Các phân tích dưới nhóm về thời gian đến khi xảy ra lần đầu một trong hai biến cố được thẩm định là tử vong do bệnh tim mạch hoặc nhập viện do suy tim
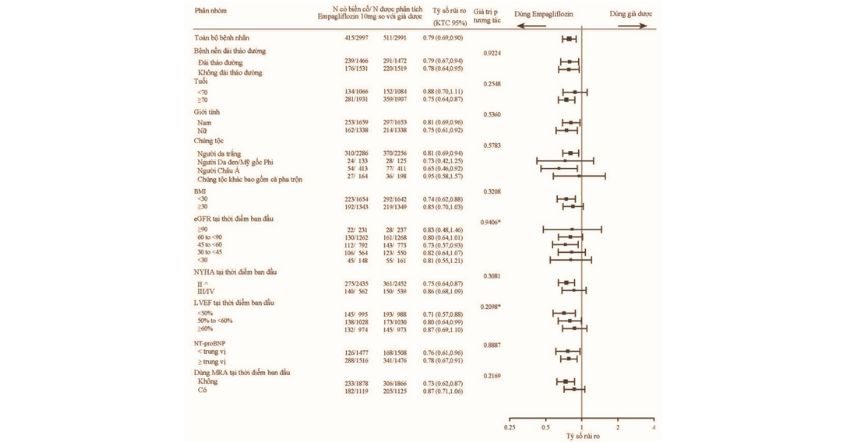
^ bệnh nhân có NYHA phân nhóm I được tính vào phân nhóm NYHA II; * kiểm định xu thế.
Kết cục trên thận
Trong thời gian điều trị, mức giảm eGFR theo thời gian chậm hơn ở nhóm bệnh nhân dùng empagliflozin so với nhóm dùng giả dược (xem Hình 15). Điều trị với empagliflozin 10mg làm giảm có ý nghĩa tỷ lệ suy giảm eGFR và hiệu quả này nhất quán trong tất cả các phân nhóm đã được xác định trước (xem Bảng 21). Bệnh nhân điều trị với empagliflozin có giảm eGFR lúc bắt đầu điều trị nhưng sau đó trở về mức ban đầu sau khi ngừng điều trị, điều này cho thấy sự thay đổi huyết động học đóng vai trò trong các ảnh hưởng tức thời của empagliflozin trên eGFR.
Hình 15. Thay đổi eGFR theo thời gian *
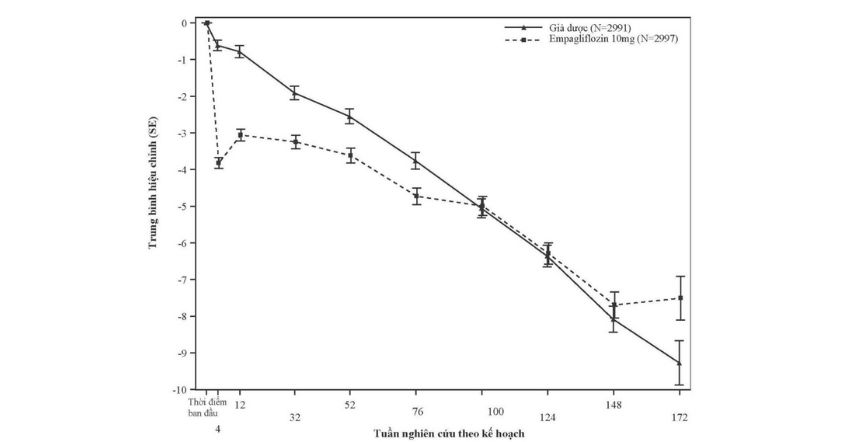
eGFR (CKD-EPI) (mL/phút/1,73m2) các kết quả MMRM theo thời gian – toàn bộ bệnh nhân được chia nhóm ngẫu nhiên. Số lượng bệnh nhân cung cấp số liệu tại các thời điểm khác nhau (giả dược, empagliflozin): ở tuần 4 (2910, 2931); ở tuần 12 (2820, 2854); ở tuần 32 (2590, 2629); ở tuần 52 (2457, 2474); ở tuần 76 (2123, 2114); ở tuần 124 (1091, 1112); ở tuần 148 (695, 686); ở tuần 172 (231, 243) và ở tuần 196 (16, 23).
Trong một phân tích tiêu chí gộp trên thận (được định nghĩa là thời gian đến khi xảy ra lần đầu một trong các biến cố sau: lọc thận mạn tính, ghép thận hoặc giảm eGFR kéo dài) tỷ số nguy cơ là 0,95 (KTC 95% 0,73 đến 1,24, giá trị p danh định = 0,7243).
Hiệu quả của empagliflozin trên các triệu chứng suy tim tại tuần 52 đã được đánh giá bởi kết quả do bệnh nhân báo cáo sử dụng sự thay đổi điểm lâm sàng tóm lược KCCQ (Kansas City Cardiomyopathy Questionnaire) so với thời điểm ban đầu, dùng để đo chỉ số trung bình tần suất xuất hiện các triệu chứng và gánh nặng đối với phù, mệt mỏi, thở gấp và những hạn chế về thể chất.
Ở nhóm bệnh nhân dùng empagliflozin, có sự cải thiện tốt hơn điểm lâm sàng tóm lược tại tuần 52 so với thời điểm ban đầu so với nhóm dùng giả dược (thay đổi trung bình so với thời điểm ban đầu được hiệu chỉnh ở nhóm dùng giả dược đã được hiệu chỉnh là 1,32, KTC 95%, CI 0,45 đến 2,19, giá trị p danh định = 0,0028), chủ yếu do tần suất triệu chứng và gánh nặng triệu chứng.
Bệnh thận mạn tính
Một nghiên cứu ngẫu nhiên, mù đôi, có đối chứng với giả dược sử dụng empagliflozin 10mg một lần mỗi ngày thêm vào điều trị chuẩn (EMPA-KIDNEY) được tiến hành trên 6609 bệnh nhân bị bệnh thận mạn tính (eGFR ≥20 – <45 ml/phút/1,73 m2; hoặc eGFR ≥45 – <90 ml/phút/1,73 m2 với tỷ số albumin/ creatinine niệu [UACR] ≥ 200 mg/g) để đánh giá kết cục tim – thận. Việc điều trị được cho phép tiếp tục ở bệnh nhân lọc máu. Tiêu chí chính là thời gian tới khi xuất hiện lần đầu bệnh thận tiến triển (giảm eGFR ≥ 40% kéo dài so với thời điểm ban đầu, eGFR <10 ml/phút/1,73 m² kéo dài, bệnh thận giai đoạn cuối hoặc tử vong do bệnh thận) hoặc tử vong tim mạch. Nhập viện do mọi nguyên nhân (lần đầu và tái nhập viện), lần đầu nhập viện do suy tim hoặc tử vong tim mạch và tử vong do mọi nguyên nhân được bao gồm trong phép kiểm khẳng định kết quả. Điều trị nền bao gồm sử dụng hợp lý thuốc ức chế RAS (85,2% thuốc ức chế ACE hoặc chẹn thụ thể angiotensin).
Tổng số có 3304 bệnh nhân được lựa chọn ngẫu nhiên vào nhóm empagliflozin 10mg (nhóm giả dược: 3305) và được theo dõi trong thời gian trung vị 24,3 tháng. Dân số nghiên cứu bao gồm 66,8% nam và 33,2% nữ với độ tuổi trung bình là 63,3 tuổi (khoảng tuổi: 18-94), 23,0% bệnh nhân từ 75 tuổi trở lên. 58,4% dân số tham gia nghiên cứu là người da trắng, 36,2% là người châu Á và 4,0% là người da đen/ người Mỹ gốc Phi.
Tại thời điểm ban đầu, eGFR trung bình là 37,3 ml/phút/1,73 m2, 21,2% bệnh nhân có eGFR ≥ 45 ml/phút/1,73 m2; 44,3% bệnh nhân có eGFR từ 30 đến <45 ml/phút/1,73 m2 và 34,5% có eGFR <30 ml/phút/1,73 m2 bao gồm 254 bệnh nhân có eGFR <20 ml/phút/1,73 m2. UACR trung vị là 329 mg/g; 20,1% bệnh nhân có UACR <30 mg/g; 28,2% bệnh nhân có UACR từ 30 đến ≤300mg/g và 51,7% bệnh nhân có UACR >300 mg/g; 41,1% bệnh nhân có UACR <200 mg/g. Các nguyên nhân hàng đầu của bệnh thận mạn tính là bệnh thận đái tháo đường/ suy thận do đái tháo đường (31%), bệnh cầu thận (25%), tăng huyết áp/ bệnh mạch máu thận (22%) và các nguyên nhân khác/ không rõ nguyên nhân (22%).
Empagliflozin có tác dụng vượt trội trong làm giảm nguy cơ xuất hiện tiêu chí gộp chính là bệnh thận tiến triển hoặc tử vong tim mạch so với giả dược. Trong một phân tích được định trước, điều trị bằng empagliflozin làm giảm 27% nguy cơ xuất hiện bệnh thận giai đoạn cuối hoặc tử vong tim mạch so với giả dược (HR 0,73, KTC 95%, 0,59 – 0,89, p danh định = 0,0023). Thêm vào đó, empagliflozin giảm rõ rệt nguy cơ nhập viện do mọi nguyên nhân (lần đầu và tái nhập viện) (xem Bảng 23).
| Bảng 23. Hiệu quả điều trị trên tiêu chí gộp chính, các tiêu chí phụ quan trọng được bao gồm trong phép kiểm khẳng định kết quả đã được xác định trước và các tiêu chí thành phần của tiêu chí gộp chính | ||
Giả dược | Empagliflozin 10 mg | |
N | 3305 | 3304 |
Thời gian xuất hiện lần đầu bệnh thận tiến triển (giảm eGFR ≥40% kéo dài so với thời điểm ban đầu, eGFR <10 ml/phút/1,73 m² kéo dài, bệnh thận giai đoạn cuối* (ESKD) hoặc tử vong do bệnh thận) hoặc tử vong tim mạch, N (%) | 558 (16,9) | 432 (13,1) |
Tỷ số nguy cơ so với giả dược (KTC 99,83%) | 0,72 (0,59, 0,89) | |
Giá trị p cho mức độ vượt trội | <0,0001 | |
Giảm eGFR ≥40% kéo dài so với thời điểm ban đầu, N (%) | 474 (14,3) | 359 (10,9) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,70 (0,61, 0,81) | |
Giá trị p | <0,0001 | |
ESKD* hoặc eGFR <10 ml/phút/1,73 m² kéo dài, N (%) | 221 (6,7) | 157 (4,8) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,69 (0,56, 0,84) | |
Giá trị p | 0,0003 | |
Tử vong do bệnh thận, N (%)** | 4 (0,1) | 4 (0,1) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | ||
Giá trị p | ||
Tử vong do bệnh tim mạch, N (%) | 69 (2,1) | 59 (1,8) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,84 (0,60, 1,19) | |
Giá trị p | 0,3366 | |
Nhập viện do mọi nguyên nhân (lần đầu và tái nhập viện), N của các biến cố | 1895 | 1611 |
Tỷ số nguy cơ so với giả dược (KTC 99,03%) | 0,86 (0,75,0,98) | |
Giá trị p | 0,0025 | |
Thời gian xuất hiện lần đầu tiên nhập viện do suy tim hoặc tử vong tim mạch, N (%) | 152 (4,6) | 131 (4,0) |
Tỷ số nguy cơ so với giả dược (KTC 98,55%) | 0,84 (0,63, 1,13) | |
Giá trị p | 0,1530 | |
Nhập viện do suy tim (xuất hiện lần đầu), N (%) | 107 (3,2) | 88 (2,7) |
Tỷ số nguy cơ so với giả dược (KTC 95%) | 0,80 (0,60, 1,06) | |
Giá trị p | 0,1263 | |
Tử vong do mọi nguyên nhân N (%) | 167 (5,1) | 148 (4,5) |
Tỷ số nguy cơ so với giả dược (KTC 97,1%) | 0,87 (0,68, 1,11) | |
Giá trị p | 0,2137 | |
eGFR = Estimated glomerular filtration rate (Độ lọc cầu thận ước tính). * Bệnh thận giai đoạn cuối (ESKD) được xác định là khi bắt đầu phải duy trì lọc máu hoặc phải ghép thận. ** Có quá ít ca tử vong do bệnh thận để tính toán được tỷ số nguy cơ đáng tin cậy. | ||
Hình 16. Thời gian đến khi xảy ra lần đầu biến cố bệnh thận tiến triển hoặc tử vong tim mạch được thẩm định, hàm tỷ lệ tích lũy ước tính
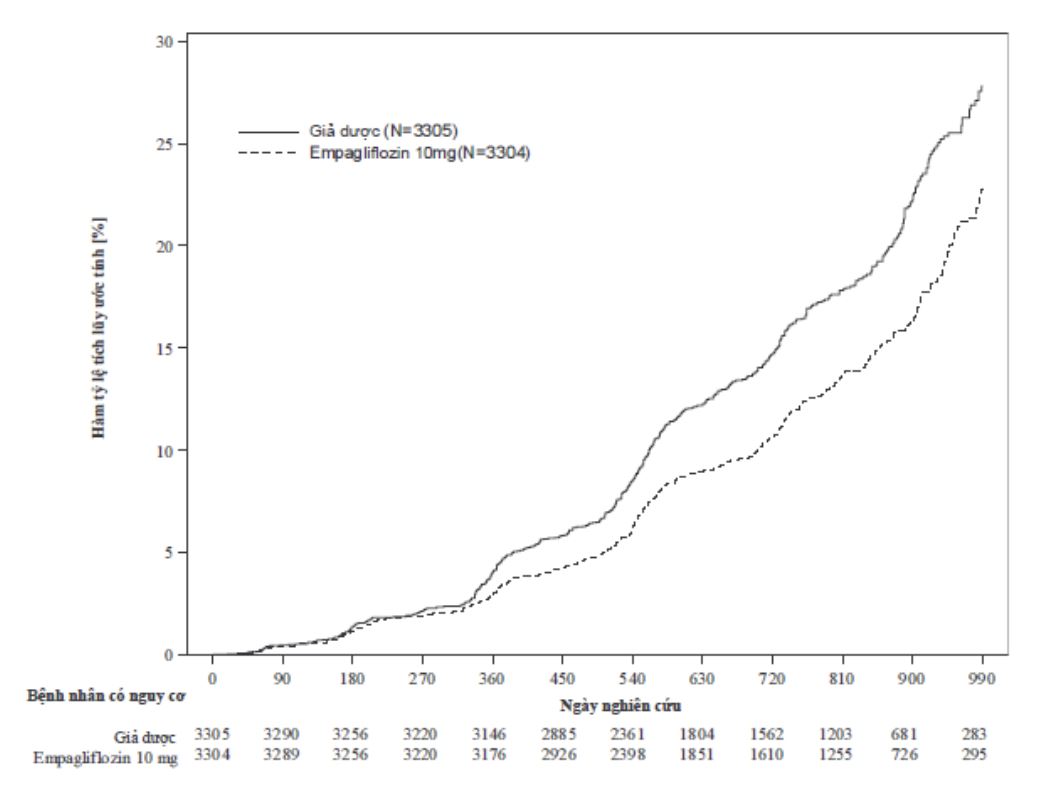
Hình 17. Xuất hiện nhập viện do mọi nguyên nhân (lần đầu và tái nhập viện), hàm tích lũy trung bình
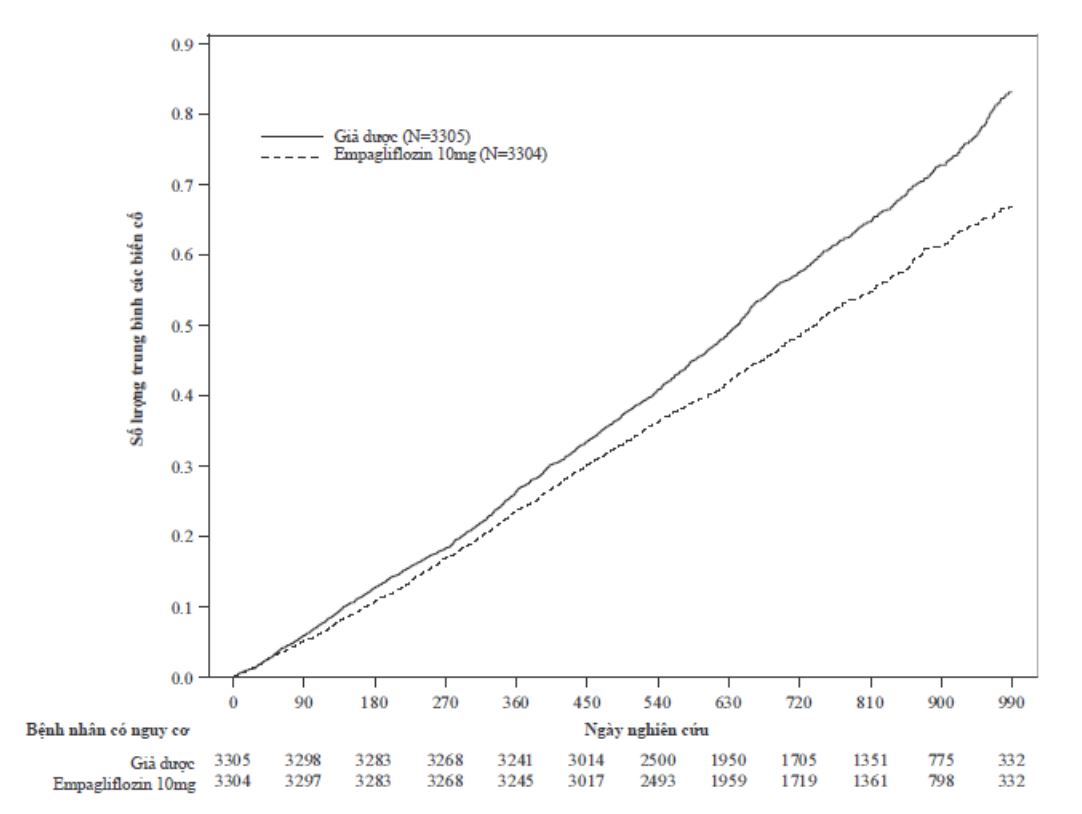
Các kết quả của tiêu chí gộp chính nhìn chung nhất quán giữa các phân nhóm đã được xác định trước bao gồm phân nhóm theo eGFR, nguyên nhân dẫn tới suy thận, tình trạng đái tháo đường, hoặc điều trị nền với các thuốc ức chế RAS. Lợi ích điều trị thể hiện rõ hơn trên bệnh nhân có mức albumin niệu cao hơn.
Empagliflozin làm chậm tốc độ giảm eGFR hàng năm 1,37 ml/phút/1,73 m2/năm (KTC 95% 1,16, 1,59) so với giả dược, dựa trên phân tích đã được xác định trước của tất cả các chỉ số eGFR thu được từ lần thăm khám 2 tháng cho tới lần theo dõi cuối cùng. Hiệu quả quan sát được là nhất quán bất kể mức albumin niệu, eGFR hay tình trạng đái tháo đường. Các số liệu này củng cố hơn cho kết luận JARDIANCE cũng cho thấy hiệu quả trên bệnh nhân có tăng albumin niệu không rõ rệt.
8. Thông tin thêm
– Đặc điểm
Dạng bào chế: Viên nén bao phim hình bầu dục, hai mặt lồi, màu vàng nhạt, một mặt dập biểu tượng công ty Boehringer Ingelheim, mặt kia dập chữ ”S25”.
– Bảo quản
Bảo quản không quá 30°C.
– Quy cách đóng gói
Hộp 3 vỉ x 10 viên.
– Hạn dùng
36 tháng kể từ ngày sản xuất.
– Nhà sản xuất
Boehringer Ingelheim Pharma GmbH & Co.KG.

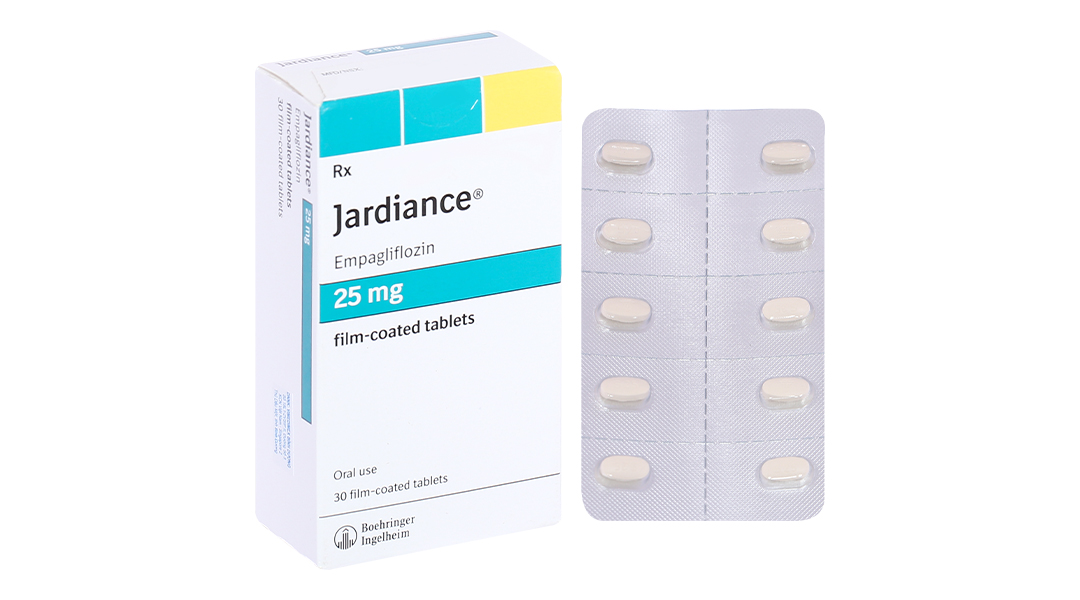






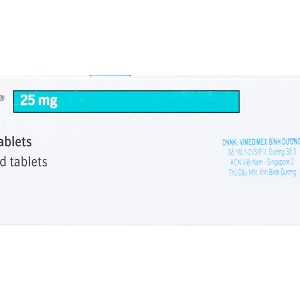









Đánh giá
Chưa có đánh giá nào.