| Mọi thông tin dưới đây đã được Dược sĩ biên soạn lại. Tuy nhiên, nội dung hoàn toàn giữ nguyên dựa trên tờ Hướng dẫn sử dụng, chỉ thay đổi về mặt hình thức. |
1. Thành phần
Mỗi viên nén chứa;
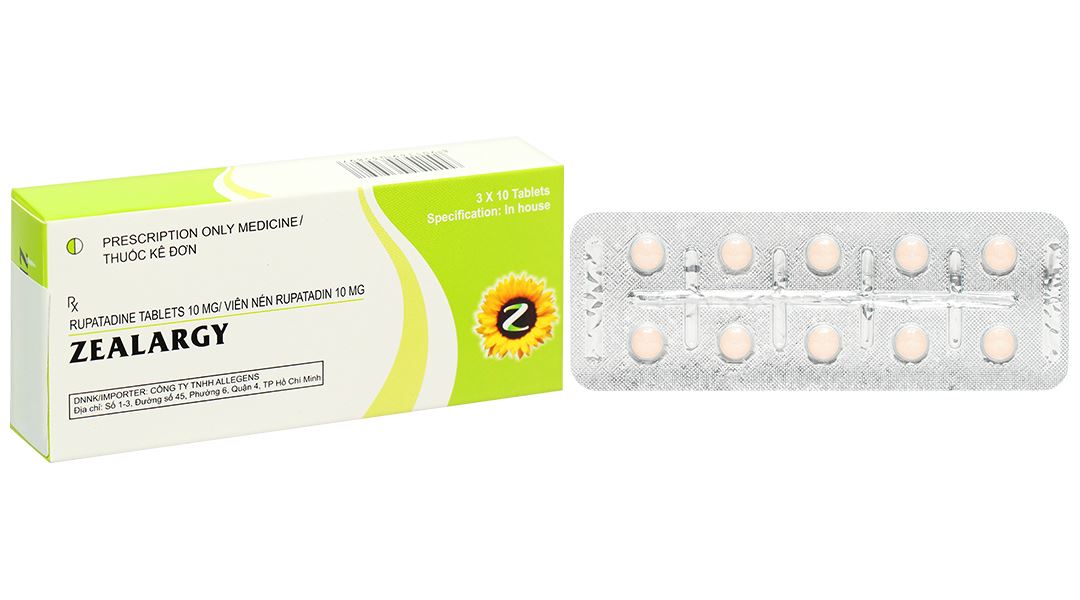
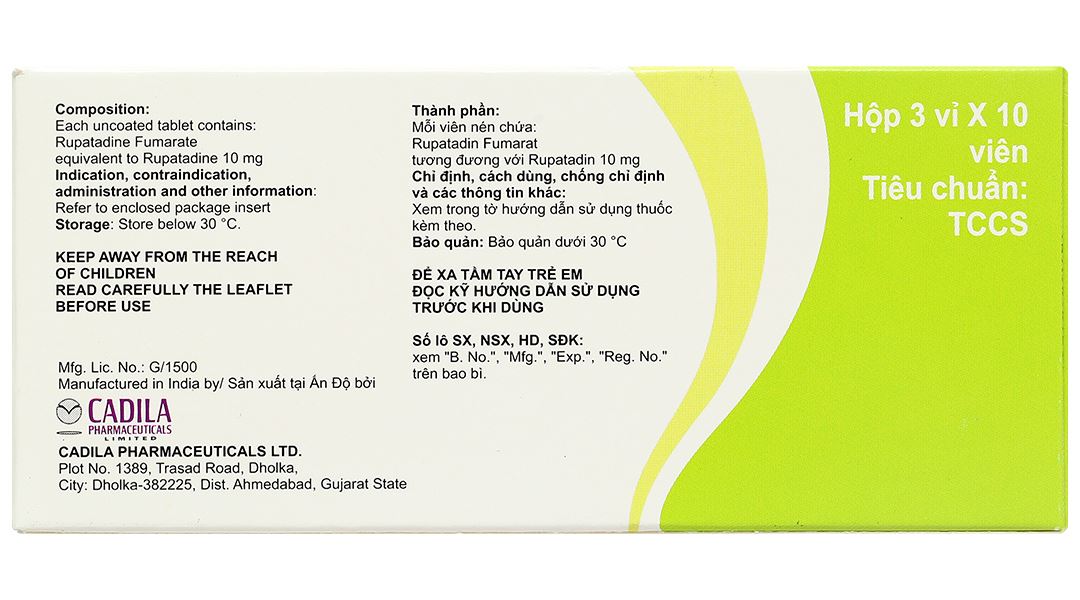
- Thành phần hoạt chất: Rupatadin fumarat tương đương rupatadin 10 mg.
- Thành phần tá dược: Lactose monohydrat, microcrystallin cellulose, pregelatinised starch, oxid sắt đỏ, oxid sắt vàng, magnesium stearat.
2. Công dụng (Chỉ định)
Điều trị triệu chứng viêm mũi dị ứng và mày đay ở người lớn và thanh thiếu niên (trên 12 tuổi).
3. Cách dùng – Liều dùng
– Cách dùng
Người lớn và thanh thiếu niên (trên 12 tuổi)
Liều khuyến cáo là 10 mg (một viên) mỗi ngày một lần, cùng hoặc không cùng thức ăn.
Người cao tuổi
Nên thận trọng khi dùng rupatadin cho người cao tuổi.
Trẻ em
- Không khuyến cáo sử dụng viên nén rupatadin 10 mg cho trẻ em dưới 12 tuổi. Ở trẻ em từ 2 đến 11 tuổi, khuyến cáo sử dụng dung dịch uống rupatadin 1 mg/ml.
Bệnh nhân suy thận hoặc gan
Vì không có kinh nghiệm lâm sàng ở những bệnh nhân bị suy giảm chức năng thận hoặc gan, hiện không khuyến cáo sử dụng viên nén 10 mg rupatadin ở những bệnh nhân này.
– Quá liều
Không có trường hợp quá liều đã được báo cáo. Trong một nghiên cứu an toàn lâm sàng, rupatadin ở liều hàng ngày 100 mg trong 6 ngày được dung nạp tốt. Phản ứng bất lợi phổ biến nhất là buồn ngủ. Nếu vô tình uống phải liều rất cao, thì nên điều trị triệu chứng cùng với các biện pháp hỗ trợ cần thiết.
4. Chống chỉ định
Quá mẫn với hoạt chất hoặc với bất kỳ tá dược nào của thuốc.
5. Tác dụng phụ
- Viên nén rupatadin 10 mg đã được sử dụng cho hơn 2043 bệnh nhân người lớn và thanh thiếu niên trong các nghiên cứu lâm sàng, 120 người trong số họ đã dùng rupatadin trong ít nhất 1 năm.
- Các tác dụng không mong muốn thường gặp nhất trong các nghiên cứu lâm sàng có đối chứng là buồn ngủ (9,4%), nhức đầu (6,9%), suy nhược (1,5%), khô miệng (1,2%) và chóng mặt (1,03%).
- Phần lớn các tác dụng không mong muốn ở mức độ nhẹ đến trung bình và thường không cần ngừng điều trị.
- Các tần số của phản ứng có hại được quy ước như sau:
- Thường gặp (≥ 1/100 đến < 1/10).
- Ít gặp (≥ 1/1000 đến < 1/100).
- Hiếm gặp (≥ 1/10.000 đến < 1 /1000).
- Tần suất của các tác dụng không mong muốn được báo cáo ở những bệnh nhân được điều trị bằng viên nén 10 mg rupatadin trong các thử nghiệm lâm sàng và báo cáo tự phát như sau:
| Hệ cơ quan | Thường gặp (≥ 1/100 đến < 1/10) | Ít gặp (≥ 1/1000 đến < 1/100) |
| Nhiễm trùng và nhiễm ký sinh trùng | Viêm họng Viêm mũi | |
| Rối loạn chuyển hóa và dinh dưỡng | Tăng cảm giác thèm ăn | |
| Rối loạn hệ thần kinh | Nhức đầu Chóng mặt Buồn ngủ | Rối loạn chú ý |
| Rối loạn hô hấp, lồng ngực và trung thất | Ho Khô họng Chảy máu cam Khô mũi Đau họng | |
| Rối loạn tiêu hóa | Khô miệng | Đau bụng Đau bụng trên Tiêu chảy Khí tiêu Buồn nôn Nôn Táo bón |
| Rối loạn da và mô dưới da | Phát ban | |
| Rối loạn cơ xương, mô liên kết và xương | Đau cơ Đau khớp Đau lưng | |
| Rối loạn toàn thân và tình trạng nơi sử dụng | Suy nhược Mệt mỏi | Khó chịu Sốt Khát nước Khó chịu |
| Xét nghiệm | Tăng alanin aminotransferase Tăng aspartat aminotransferase Tăng creatin phosphokinase huyết Xét nghiệm chức năng gan bất thường Tăng cân |
Ngoài ra, hai tác dụng không mong muốn hiếm gặp đã được bảo cáo sau khi đưa ra thị trường gồm: nhịp tim nhanh và đánh trống ngực và các phản ứng quá mẫn (bao gồm phản ứng phản vệ, phù mạch và nổi mề đay) đã được báo cáo sau hậu mãi.
6. Lưu ý |
– Thận trọng khi sử dụng
– Thai kỳ và cho con búSử dụng thuốc cho phụ nữ có thai Hiện có ít dữ liệu về việc sử dụng rupatadin ở phụ nữ có thai. Các nghiên cứu trên động vật không chỉ ra những tác động có hại trực tiếp hoặc gián tiếp đối với thai nghén, sự phát triển của phôi thai / bào thai, sự sinh nở hoặc sự phát triển sau khi sinh. Như một biện pháp phòng ngừa, tốt nhất là tránh sử dụng rupatadin trong thời kỳ mang thai. Sử dụng thuốc cho phụ nữ cho con bú Rupatadin được bài tiết qua sữa ở động vật. Hiện chưa rõ liệu rupatadin có bài tiết vào sữa mẹ ở người hay không. Phải đưa ra quyết định có nên ngừng cho con bú hoặc ngừng/bỏ điều trị bằng rupatadin có tính đến lợi ích của việc cho con bú đối với đứa trẻ và lợi ích của điều trị đối với người phụ nữ. Khả năng sinh sản Không có dữ liệu lâm sàng về khả năng sinh sản. Các nghiên cứu trên động vật cho thấy khả năng sinh sản giảm đáng kể ở mức độ phơi nhiễm cao hơn so với mức quan sát được ở người ở liều điều trị tối đa. – Khả năng lái xe và vận hành máy mócRupatadin 10 mg không ảnh hưởng đến khả năng lái xe và sử dụng máy móc. Tuy nhiên, xe hoặc sử dụng máy móc cho đến khi đáp ứng cá nhân của bệnh nhân với rupatadin được thiết lập. – Tương tác thuốcTương tác: Nghiên cứu tương tác với viên nén 10 mg rupatadin chỉ được thực hiện ở người lớn và thanh thiếu niên (trên 12 tuổi). Ảnh hưởng của các loại thuốc khác đối với rupatadin
Ảnh hưởng của rapatadin đối với các loại thuốc khác: Thận trọng khi dùng chung rupatadin với các thuốc chuyển hóa khác có khoảng trị liệu hẹp vì kiến thức về tác dụng của rupatadin đối với các thuốc khác còn hạn chế. Tương tác với rượu: Sau khi uống rượu, liều 10 mg rupatadin gây ra tác dụng không mong muốn trong một số bài kiểm tra hiệu suất tâm thần vận động mặc dù chúng không khác biệt đáng kể so với tác dụng không mong muốn chỉ gây ra khi uống rượu. Liều 20 mg làm tăng khả năng suy giảm do uống nhiều rượu. Tương tác với thuốc ức chế thần kinh trung ương: Cũng như các thuốc kháng histamin khác, không thể loại trừ tương tác với thuốc ức chế thần kinh trung ương. Tương tác với statin: Tăng CPK không triệu chứng đã được báo cáo ít gặp trong các thử nghiệm lâm sàng với rupatadin. Một số statin cũng được chuyển hóa bởi isoenzym cytochrom P450 CYP3A4, nguy cơ tương tác với statin vẫn chưa được biết. Vì những lý do này, nên thận trọng khi sử dụng rupatadin cùng với statin. Tương tác với midazolam: Sau khi dùng 10 mg rupatadin kết hợp với 7,5 mg midazolam, có sự gia tăng nhẹ nồng độ (Cmax và AUC) của midazolam. Vì vậy, rupaladin hoạt động như một chất ức chế nhẹ CYP3A4. Tương kỵ Do không có các nghiên cứu về tính tương kỵ của thuốc, không trộn lẫn thuốc này với các thuốc khác. |
7. Dược lý
– Dược lực học (Tác động của thuốc lên cơ thể)
- Nhóm dược lý: Thuốc kháng histamin khác sử dụng toàn thân.
- Mã ATC: R06AX28.
- Rupatadin là thuốc kháng histamin thế hệ thứ hai, đối kháng histamin tác dụng kéo dài, với hoạt tính đối kháng thụ thể H1 ngoại vi có chọn lọc. Một số chất chuyển hóa (desloratadin và các chất chuyển hóa hydroxyl hóa của nó) giữ được hoạt tính kháng histamin và có thể góp phần một phần vào hiệu quả tổng thể của thuốc.
- Các nghiên cứu in vitro với rupatadin ở nồng độ cao đã cho thấy sự ức chế sự suy giảm của tế bào mast do các kích thích miễn dịch và không miễn dịch cũng như giải phóng các cytokin, đặc biệt là TNFα trong tế bào mast và bạch cầu đơn nhân. Sự liên quan về mặt lâm sàng của các dữ liệu thí nghiệm quan sát được vẫn còn được xác nhận.
- Các thử nghiệm lâm sàng ở người tình nguyện (n = 393) và bệnh nhân (n = 2650) bị viêm mũi dị ứng và mày đay tự phát mạn tính không cho thấy tác dụng đáng kể trên điện tâm đồ khi dùng rupatadin với liều từ 2 mg đến 100 mg. Mề đay tự phát mạn tính được nghiên cứu như một mô hình lâm sàng cho các tình trạng nổi mề đay, vì sinh lý bệnh cơ bản là tương tự nhau, bất kể nguyên nhân gây bệnh, và vì bệnh nhân mạn tính có thể dễ dàng được chiêu mộ hơn. Vì sự giải phóng histamin là một yếu tố nguyên nhân trong tất cả các bệnh nổi mề đay, nên rupatadin được kỳ vọng sẽ có hiệu quả trong việc giảm triệu chứng đối với các tình trạng nổi mề đay khác, ngoài bệnh mề đay tự phát mạn tính, như đã được khuyến cáo trong hướng dẫn lâm sàng.
- Trong một thử nghiệm có đối chứng với giả dược ở bệnh nhân mề đay vô căn mạn tính, rupatadin có hiệu quả làm giảm điểm ngứa trung bình so với ban đầu trong thời gian điều trị 4 tuần (thay đổi so với ban đầu: rupatadin 57,5%, giả dược 44,9%) và giảm số lần thở rít (54,3% so với 39,7%).
– Dược động học (Tác động của cơ thể với thuốc)
Hấp thu và sinh khả dụng
- Rupatadin được hấp thu nhanh chóng sau khi uống, với Tmax khoảng 0,75 giờ sau khi uống. Cmax trung bình là 2,6 ng/ml sau khi uống một liều duy nhất 10 mg và 4,6 ng/ml sau một liều uống duy nhất 20 mg. Dược động học của rupatadin là tuyến tính đối với liều từ 10 đến 20 mg sau khi dùng liều đơn và liều lặp lại. Sau liều 10 mg x 1 lần/ngày trong 7 ngày, Cmax trung bình là 3,8 ng/ml. Nồng độ trong huyết tương giảm theo hai hàm mũ với thời gian bán thải trung bình là 5,9 giờ. Tỷ lệ gắn kết của rupatadin với protein huyết tương là 98,5 – 99%.
- Vì rupatadin chưa bao giờ được sử dụng cho người bằng đường tiêm tĩnh mạch, không có dữ liệu nào về sinh khả dụng tuyệt đối của nó.
Ảnh hưởng của thức ăn
Thức ăn làm tăng nồng độ toàn thân (AUC) của rupatadin lên khoảng 23%. Nồng độ của một trong các chất chuyển hóa có hoạt tính và chất chuyển hóa chính không hoạt tính trên thực tế là như nhau (giảm tương ứng khoảng 5% và 3%). Thời gian để đạt được nồng độ tối đa trong huyết tương (Tmax) của rupatadin bị chậm lại 1 giờ. Nồng độ tối đa trong huyết tương (Cmax) không bị ảnh hưởng bởi lượng thức ăn. Những khác biệt này không có ý nghĩa lâm sàng.
Chuyển hóa và thải trừ
- Trong một nghiên cứu về sự bài tiết ở người (40 mg 14C-rupatadin), 34,6% hoạt độ phóng xạ sử dụng được thu hồi trong nước tiểu và 60,9% trong phân được thu thập trong 7 ngày. Rupatadin trải qua quá trình chuyển hóa đáng kể trước khi vào vòng tuần hoàn toàn thân khi dùng đường uống. Lượng hoạt chất không thay đổi được tìm thấy trong nước tiểu và phân là không đáng kể. Điều này có nghĩa là rupatadin được chuyển hóa gần như hoàn toàn. Thông thường, các chất chuyển hóa có hoạt tính desloratadin và các dẫn xuất hydroxyl hóa khác lần lượt chiếm 27% và 48% trong tổng số phơi nhiễm toàn thân của các chất hoạt tính. Các nghiên cứu về chuyển hóa in vitro trên microsom gan người chỉ ra rằng rupatadin được chuyển hóa chủ yếu bởi cytochrom P450 (CYP 3A4).
- Dựa trên các nghiên cứu in vitro, khả năng ức chế của rupatadin đối với CYP1A2, CYP2B6, CYP2C8, CYP2C19, UGT1A1 và UGT2B7 là không thể xảy ra. Rupatadin dự kiến sẽ không ức chế các chất vận chuyển sau đây trong hệ tuần hoàn như OATP1B1, OATP1B3 và BCRP (protein kháng ung thư vú) gan và ruột. Hơn nữa, một sự ức chế nhẹ đã được phát hiện đối với P-gp (P-glycoprotein) trong ruột.
- Một nghiên cứu in vitro về cảm ứng CYP trên nguy cơ cảm ứng CYP1A2, CYP2B6 và CYP3A4 ở gan in vivo bởi rupatadin được coi là không cần thiết. Dựa trên nghiên cứu in vivo, rupatadin là chất ức chế nhẹ CYP3A4.
Các nhóm bệnh nhân đặc biệt
Trong một nghiên cứu trên những người tình nguyện khỏe mạnh để so sánh kết quả ở người trưởng thành và người cao tuổi, giá trị AUC và Cmax của rupatadin ở người cao tuổi cao hơn ở người trưởng thành. Điều này có thể là do giảm chuyển hóa qua gan ở người cao tuổi. Những khác biệt này không được quan sát thấy trong các chất chuyển hóa được phân tích. Thời gian bán thải trung bình của rupatadin ở người tình nguyện cao tuổi và thanh niên lần lượt là 8,7 giờ và 5,9 giờ. Vì những kết quả này đối với rupatadin và các chất chuyển hóa của nó không có ý nghĩa về mặt lâm sàng, người ta kết luận rằng không cần thiết phải điều chỉnh khi sử dụng liều 10 mg ở người cao tuổi.
8. Thông tin thêm
– Đặc điểm
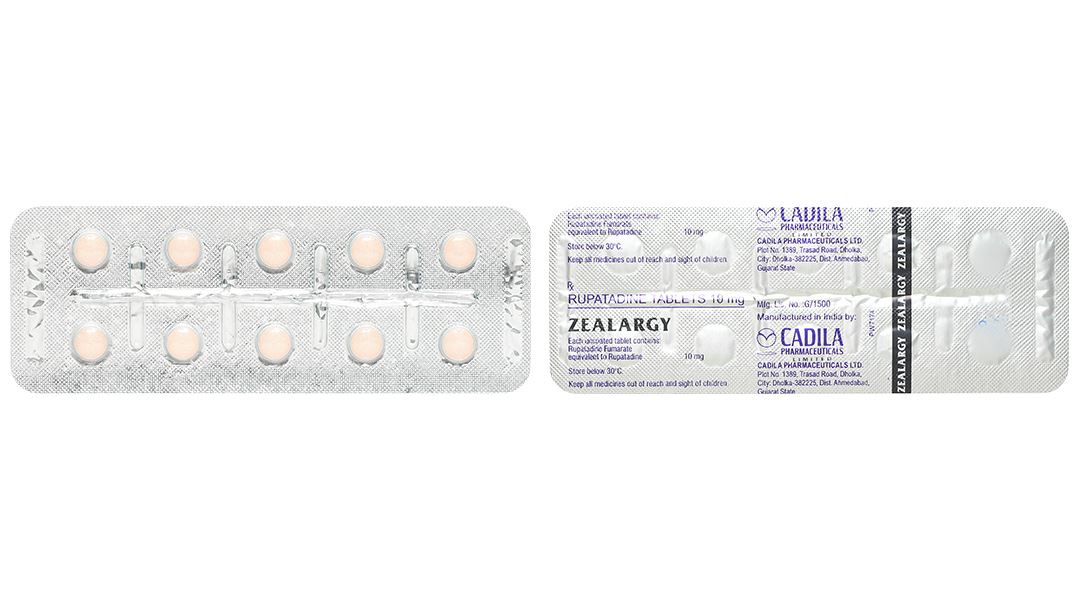
Viên nén không bao màu hồng cam, hình tròn, hai mặt lồi, nhẵn.
– Bảo quản
Bảo quản dưới 30 độ C.
– Quy cách đóng gói
Hộp 3 vỉ x 10 viên.
– Hạn dùng
24 tháng kể từ ngày sản xuất.
– Nhà sản xuất
Cadila Pharmaceuticals Ltd.















Đánh giá
Chưa có đánh giá nào.