| Mọi thông tin dưới đây đã được Dược sĩ biên soạn lại. Tuy nhiên, nội dung hoàn toàn giữ nguyên dựa trên tờ Hướng dẫn sử dụng, chỉ thay đổi về mặt hình thức. |
1. Thành phần
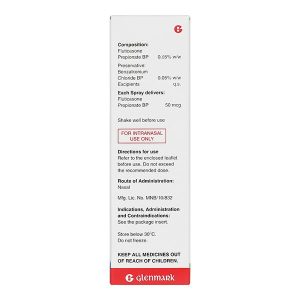
Thành phần hoạt chất: Hỗn dịch nước của fluticason propionat BP 0,05% kl/kl. Mỗi liều xịt cung cấp 50mcg fluticason propionat BP.
Thành phần tá dược; cellulose vi tinh thể và natri carboxymethyl cellulose (Avicel RC 591), natri hydroxit, dinatri edetat, polysorbat 80 (Tween 80 siêu mịn), dextrose khan, benzalkonium clorid BP, nước cất pha tiêm.
Tả được có tác dụng đã được biết đến: Benzalkonium clorid BP.
2. Công dụng (Chỉ định)
Thuốc Flusort được chỉ định dùng trong các trường hợp sau:
- Phòng và điều trị chứng viêm mũi dị ứng theo mùa (bao gồm sốt cỏ khô (hay fever)) và viêm mũi quanh năm.
- Fluticason propionat có khả năng chống viêm mạnh nhưng khi sử dụng tại chỗ trên niêm mạc mũi không cho thấy tác dụng chống viêm toàn thân.
3. Cách dùng – Liều dùng
Cách dùng
- Thuốc xịt mũi Fluticasone chỉ dùng đường trong mũi.
- Tránh tiếp xúc trực tiếp với mắt.
Hướng dẫn bệnh nhân sử dụng Flusort
- Tháo nắp nhựa.
- Trước khi sử dụng FLUSORT lần đầu, xịt thử bằng cách ấn xuống 2 bên của đầu xịt màu trắng bằng ngón trỏ và ngón giữa trong khi giữ chặt đáy chai bằng ngón tay cái. Không cắt đầu xịt. Ấn nhẹ xuống và thả ra để xịt 10 lần hoặc cho đến khi thuốc xịt ra tốt. Không được xịt vào mắt. Bình xịt đã sẵn sàng để sử dụng. Bình xịt có thể bảo quản không sử dụng tối đa 1 tuần mà không cần phải xịt thử. Trước khi sử dụng lại cần xịt thử 2 lần hoặc cho đến khi thuốc xịt tốt.
- Hỉ mũi nhẹ để làm sạch lỗ mũi. Bịt 1 bên mũi. Nghiêng đầu nhẹ về phía trước, giữ chai thẳng đứng, để đầu xịt cẩn thận vào trong lỗ mũi kia. Không xịt trực tiếp vào vách ngăn mũi.
- Sau đó thở qua miệng.
- Lặp lại với lỗ mũi bên kia.
- Lau mũi bằng khăn giấy sạch và lắp lại nắp nhựa.
Hướng dẫn bệnh nhân vệ sinh dụng cụ
- Để làm sạch đầu xịt, tháo nắp nhựa ra.
- Kéo nhẹ để tháo đầu xịt màu trắng ra.
- Ngâm đầu xịt trong nước lạnh, rửa sạch hai đầu của đầu xịt dưới vòi nước và lau khô. Đừng cố gắng thông đầu xịt bằng một vật sắc nhọn vì sẽ làm hỏng đầu xịt và khiến việc định liều thuốc không đúng.
- Rửa sạch nắp nhựa dưới nước và để khô.
- Lắp lại đầu xịt, đảm bảo vòi bơm được gắn lại vào lỗ trung tâm của đầu xịt.
- Thử bình xịt bằng cách ấn xuống hai bên của đầu xịt màu trắng bằng ngón trỏ và ngón giữa trong khi dùng ngón cái giữ đáy chai. Án xuống và thả ra 2 lần hoặc đến khi thuốc xịt ra tốt. Không được xịt vào mắt. Bình xịt bây giờ đã sẵn sàng để sử dụng. Có thể bảo quản bình xịt không sử dụng tối đa 1 tuần mà không cần phải thử bình xịt. Trước khi sử dụng lại cần xịt thử 2 lần hoặc cho đến khi thuốc xịt tốt.
- Lắp lại nắp nhựa.
Tham khảo cách sử dụng Flusort và cách vệ sinh dụng cụ: Tại đây.
Liều dùng
Người lớn và trẻ em trên 12 tuổi
- Dùng để phòng và điều trị viêm mũi dị ứng theo mùa và viêm mũi quanh năm. Hai lần xịt cho mỗi bên mũi, một lần mỗi ngày, nên dùng vào buổi sáng.
- Trong một số trường hợp có thể yêu cầu dùng hai lần xịt cho mỗi bên mũi, hai lần mỗi ngày. Một khi các triệu chứng đã được kiểm soát, có thể duy trì liều dùng ở mức một lần xịt cho mỗi bên mũi, một lần mỗi ngày.
- Nếu các triệu chứng tái phát, liều dùng có thể cần tăng lên cho phù hợp. Cần duy trì liều tối thiểu kiểm soát hiệu quả các triệu chứng. Không được vượt quá liều tối đa hàng ngày là bốn lần xịt cho mỗi bên mũi.
Người già
- Có thể dùng liều thông thường cho người lớn.
Trẻ em dưới 12 tuổi
- Dùng để phòng và điều trị viêm mũi dị ứng theo mùa và viêm mũi quanh năm ở trẻ em từ 4 đến 11 tuổi với liều một lần xịt cho mỗi bên mũi, một lần mỗi ngày và nên dùng vào buổi sáng. Trong một số trường hợp có thể dùng liều một lần xịt cho mỗi bên mũi, hai lần mỗi ngày. Liều tối đa hàng ngày không được phép vượt quá hai lần xịt cho mỗi bên mũi, cần duy trì liều tối thiểu kiểm soát hiệu quả các triệu chứng.
Việc dùng thuốc đều đặn để đạt được hiệu quả tối ưu là rất quan trọng. Do sự giảm tối đa triệu chứng chỉ có thể đạt sau 3 đến 4 ngày điều trị, cần giải thích cho bệnh nhân hiểu nếu chưa có hiệu quả tức thời.
– Quá liều
Chưa có dữ liệu về tác động của quá liều cấp tính hay mạn tính đối với thuốc fluticason xịt mũi. Việc dùng đường mũi ở liều 2mg fluticason propionat hai lần mỗi ngày trong bảy ngày trên các tình nguyện viên khỏe mạnh không cho thấy tác động trên chức năng của trục dưới đồi – tuyến yên – thượng thận (HPA).
Việc dùng đường hát hoặc đường miệng liều cao corticosteroid trong thời gian kéo dài có thể gây suy giảm chức năng trục dưới đồi – tuyến yên – thượng thận.
Điều trị
- Việc dùng thuốc ở liều cao hơn liều khuyến cáo trong thời gian dài có thể dẫn tới suy giảm tạm thời chức năng thượng thận.
- Đối với những bệnh nhân này, việc điều trị với fluticason propionat cần được tiếp tục duy trì ở liều vừa đủ để kiểm soát.
4. Chống chỉ định
Thuốc Flusort chống chỉ định trong trường hợp quá mẫn cảm với hoạt chất hoặc bất cứ thành phần tá dược của thuốc.
5. Tác dụng phụ
Các tác dụng không mong muốn được liệt kê dưới đây theo hệ thống cơ quan và tần suất. Tần suất được phân loại như sau: Rất phổ biến (≥1/10); phổ biến (≥1/100 đến <1/10); ít gặp (≥1/1000 đến <1/100); hiếm gặp (≥1/10000 đến <1/1000) và rất hiếm gặp (<1/10000) bao gồm các báo cáo độc lập. Các tác dụng không mong muốn rất phổ biến, phổ biến và ít gặp được ghi nhận từ dữ liệu thử nghiệm lâm sàng. Các biến cố hiếm gặp và rất hiếm gặp chủ yếu được ghi nhận từ các báo cáo tự phát. Trong mục tần suất xảy ra của các tác dụng không mong muốn, không tính đến các tỉ lệ nền trong các nhóm sử dụng giả dược.
Bảng 1: Bảng tóm tắt các tác dụng không mong muốn
Phân loại hệ thống cơ quan | Tần suất | Tác dụng không mong muốn |
Rối loạn hệ miễn dịch | Rất hiếm | Phản ứng quá mẫn cảm với các biểu hiện sau: Phản ứng mẫn cảm trên da Phù mạch (chủ yếu trên mặt và phù nề hầu họng) Các triệu chứng về hô hấp (co thắt phế quản) Các phản ứng phản vệ |
Rối loạn hệ thần kinh | Phổ biến | Đau đầu, mùi, vị khó chịu |
Rối loạn về mặt | Rất hiếm | Tăng nhãn áp, tăng áp lực trong mắt, đục thủy tinh thể. Những biến cố này đã được xác nhận từ các báo cáo tự phát sau quá trình điều trị dài ngày |
Rối loạn hô hấp, ngực và trung thất | Rất phổ biến | Chảy máu cam |
Phổ biến | Khô mũi, kích ứng mũi, khô họng, kích ứng họng | |
Rất hiếm | Thủng vách ngăn mũi |
Tương tự các thuốc xịt mũi khác, đã có các báo cáo về hiện tượng mùi vị khó chịu và đau đầu.
Tương tự các thuốc xịt mũi khác, đã có các báo cáo về hiện tượng khô và kích ứng mũi họng và chảy máu cam. Thủng vách ngăn mũi đã được báo cáo sau khi dùng corticosteroid đường mũi.
Các tác dụng toàn thân của một số corticosteroid đường mũi có thể xảy ra, đặc biệt khi được kê ở liều cao trong một thời gian dài.
Báo cáo các tác dụng không mong muốn
Báo cáo các tác dụng không mong muốn sau khi thuốc được cấp phép là rất quan trọng. Điều này cho phép tiếp tục kiểm soát cân bằng giữa lợi ích/nguy cơ của thuốc. Các nhân viên y tế cần báo cáo bất cứ tác dụng không mong muốn nào thông qua hệ thống báo cáo quốc gia.
Hướng dẫn cách xử trí ADR
Khi gặp tác dụng phụ của thuốc, cần ngưng sử dụng và thông báo cho bác sĩ hoặc đến cơ sở y tế gần nhất để được xử trí kịp thời.
6. Lưu ý |
– Thận trọng khi sử dụngNhiễm khuẩn tại chỗ: Nhiễm khuẩn đường thở cần được điều trị một cách thích hợp nhưng không dẫn tới chống chỉ định điều trị bằng thuốc xịt mũi fluticasone. Tác dụng điều trị tối ưu của thuốc xịt mũi fluticasone chỉ có thể đạt được sau khi dùng dài ngày. Cần thận trọng khi chuyển thuốc điều trị cho bệnh nhân từ steroid tác dụng toàn thân sang dùng fluticasone xịt mũi nếu có bất cứ dấu hiệu nào cho thấy bệnh nhân bị suy thượng thận. Mặc dù fluticason xịt mũi sẽ kiểm soát hầu hết các trường hợp viêm mũi dị ứng theo mùa, việc bệnh nhân tiếp xúc nhiều một cách bất thường với các dị nguyên mùa hè trong một số trường hợp có thể đòi hỏi phải được điều trị bổ sung một cách phù hợp. Tác dụng toàn thân của corticosteroid đường mũi có thể xảy ra đặc biệt khi dùng liều cao trong thời gian dài. Những tác động này ít xảy ra hơn so với khi dùng các dạng bào chế corticosteroid uống và có thể khác nhau giữa các bệnh nhân và giữa các dạng bào chế khác nhau của corticosteroid. Nguy cơ tác động toàn thân có thể bao gồm hội chứng Cushing, các đặc tính của hội chứng Cushing, ức chế thượng thận, làm chậm phát triển ở trẻ em và thanh thiếu niên, đục thủy tinh thể, tăng nhãn áp và hiếm gặp hơn là một loạt các triệu chứng tâm lý hay tác động lên hành vi bao gồm trạng thái hiếu động quá mức, rối loạn giấc ngủ, lo âu, trầm cảm hoặc hung hăng (đặc biệt ở trẻ em). Chậm phát triển đã được báo cáo ở trẻ em sử dụng một số corticosteroid đường mũi ở liều lượng được cấp phép. Việc kiểm soát chiều cao một cách thường xuyên được khuyến cáo ở những trẻ em được điều trị dài ngày với corticosteroid đường mũi. Nếu sự tăng trưởng của trẻ bị chậm lại, việc điều trị cần được xem xét lại nhằm mục đích giảm liều corticosteroid xịt mũi, nếu có thể, xuống liều thấp nhất có hiệu lực duy trì kiểm soát các triệu chứng. Thêm vào đó, cần cân nhắc tư vấn bệnh nhân tới gặp bác sĩ chuyên khoa nhi. Việc điều trị với liều cao hơn liều khuyến cáo của corticosteroid đường mũi có thể gây ức chế thượng thận đáng kể trên lâm sàng. Nếu có căn cứ cho việc sử dụng liều cao hơn liều khuyến cáo, cần cân nhắc bổ sung corticosteroid đường toàn thân trong những giai đoạn căng thẳng hoặc phẫu thuật lựa chọn. Hiệu quả tối ưu của hỗn dịch xịt mũi fluticasone propionate có thể đạt được sau vài ngày sử dụng thuốc. Ritonavir có thể làm tăng đáng kể nồng độ của fluticason propionat trong huyết tương. Do đó, cần tránh sử dụng đồng thời hai thuốc này, trừ khi lợi ích có thể đạt được cho bệnh nhân hơn hẳn nguy cơ gây tác dụng phụ của các thuốc corticosteroid đường toàn thân. Ngoài ra cũng có nguy cơ tăng tác dụng không mong muốn toàn thân khi phối hợp fluticason propionat với các chất ức chế CYP3A khác. Thuốc xịt mũi Fluticasone chứa benzalkonium clorid là chất có thể gây co thắt phế quản. – Thai kỳ và cho con búThời kỳ mang thai
Thời kỳ cho con bú
– Khả năng lái xe và vận hành máy mócKhông ghi nhận. – Tương tác thuốcTrong các trường hợp thông thường, nồng độ fluticason propionat trong huyết tương đạt được ở mức thấp sau khi bệnh nhân hít thuốc, do chuyển hóa vòng đầu qua gan mạnh và thải trừ mạnh toàn thân thông qua cytochrom P450 3A4 ở ruột và gan. Do đó, có ít khả năng fluticason propionat có thể là trung gian gây tương tác thuốc một cách đáng kể về lâm sàng. Trong một nghiên cứu về tương tác thuốc trên các đối tượng khỏe mạnh sử dụng fluticason propionat đường mũi và ritonavir (một chất ức chế mạnh cytochrome P450 3A4) với liều 100mg hai lần mỗi ngày làm tăng nồng độ fluticason propionat huyết tương vài trăm lần, gây ra sự giảm đáng kể nồng độ cortisol huyết thanh. Các trường hợp bệnh nhân mắc hội chứng Cushing và suy thượng thận đã được báo cáo. Cần tránh kết hợp hai thuốc trên trừ khi lợi ích vượt trội nguy cơ gia tăng của tác dụng phụ toàn thân của glucocorticoid. Trong một nghiên cứu nhỏ sử dụng fluticasone propionate dạng hít trên các tình nguyện viên khỏe mạnh, ketoconazol là một chất ức chế CYP3A4 yếu hơn làm tăng nồng độ fluticason propionat sau một lần hít vào duy nhất lên 150%. Điều này dẫn đến sự giảm đáng kể nồng độ cortisol huyết tương so với khi dùng fluticason propionat đơn lẻ. Việc kết hợp điều trị với các thuốc ức chế mạnh CYP3A khác, ví dụ itraconazole, cũng có thể làm tăng nồng độ fluticason propionat toàn thân và tăng nguy cơ tác dụng phụ toàn thân, cần thận trọng và tránh điều trị dài ngày với những thuốc trên nếu có thể. Các nghiên cứu đã cho thấy các chất ức chế cytochrom P450 3A4 khác gây ra sự tăng không đáng kể (erythromycin) và tăng nhẹ (ketoconazol) nồng độ fluticason propionat trong máu mà không làm giảm đáng kể nồng độ cortisol huyết thanh. Tuy vậy, nên thận trọng khi phối hợp sử dụng những thuốc ức chế cytochrom P450 3A4 (ví dụ như ketoconazol), do có nguy cơ làm tăng nồng độ fluticason propionat trong máu. |
7. Dược lý
– Dược lực học (Tác động của thuốc lên cơ thể)
Nhóm tác dụng điều trị: Chống sung huyết và các dạng bào chế khác của corticosteroid dùng tại chỗ đường mũi.
Mã ATC:RO1AD08.
Fluticason propionat gây ra ít hoặc không ảnh hưởng tới trục dưới đồi – tuyến yên – tuyến thượng thận khi dùng đường mũi.
– Dược động học (Tác động của cơ thể với thuốc)
Hấp thu
Khi dùng đường mũi fluticason propionat với liều 200mcg/ngày, nồng độ tối đa ở trạng thái ổn định trong huyết tương là không định lượng được ở hầu hết các đối tượng (< 0,01ng/ml). Nồng độ cao nhất Cmax quan sát được là 0,017ng/ml. Sự hấp thu trực tiếp tại mũi là không đáng kể do ít tan trong nước và phần lớn liều thuốc đã được nuốt. Khi dùng đường miệng, nồng độ thuốc trong máu là < 1% do hấp thu kém và quá trình chuyển hóa trước tuần hoàn. Do đó, tổng hấp thu vào tuần hoàn từ hấp thu đường mũi và đường miệng của liều đã nuốt là không đáng kể.
Phân bố
Một lượng lớn fluticason propionat dược phân bố ở trạng thái ổn định (xấp xỉ 318L). Liên kết protein huyết tương tương đối mạnh (91%).
Chuyển hóa
Fluticason propionat biến mất nhanh chóng khỏi hệ tuần hoàn, chủ yếu do sự chuyển hóa qua gan thành dạng chất chuyển hóa axit carboxylic mất hoạt tính, bởi cytochrom P450 enzym CYP3A4. Lượng fluticason propionat được nuốt vào cũng được chuyển hóa mạnh vòng đầu qua gan. Cần thận trọng khi phối hợp các chất ức chế CYP3A4 như ketoconazol và ritonavir do có nguy cơ làm tăng nồng độ fluticason trong máu.
Thải trừ
Tốc độ thải trừ của fluticason propionat đường tĩnh mạch là tuyến tính trong khoảng liều từ 250 – 1000mcg và được đặc trưng bởi độ thanh thải huyết tương cao (CL = 1,1 L/phút). Nồng độ đỉnh trong huyết tương giảm xấp xỉ 98% trong vòng 34 giờ và chỉ còn nồng độ thấp trong huyết tương kết hợp với thời gian bán thải cuối cùng là 7,8 giờ.
Sự đào thải qua thận của fluticason propionat là không đáng kể (< 0,2%) và thấp hơn mức 5% của chất chuyển hóa axit carboxylic.
Con đường thải trừ chính của fluticason propionat và các chất chuyển hóa của nó là qua đường mật.
Dữ liệu tiền lâm sàng
Chưa có thêm dữ liệu tiền lâm sàng nào so với các dữ liệu đã được đề cập trong các mục khác.
8. Thông tin thêm
– Đặc điểm
Dạng bào chế: Hỗn dịch trong nước để xịt mũi thông qua bơm phun định liều.
– Bảo quản
Bảo quản ở nhiệt độ dưới 30°C. Không để đông lạnh.
– Quy cách đóng gói
Hộp 1 chai xịt 120 liều.
– Hạn dùng
24 tháng kể từ ngày sản xuất.
– Nhà sản xuất
Glenmark Pharmaceuticals Ltd.
















Đánh giá
Chưa có đánh giá nào.