| Mọi thông tin dưới đây đã được Dược sĩ biên soạn lại. Tuy nhiên, nội dung hoàn toàn giữ nguyên dựa trên tờ Hướng dẫn sử dụng, chỉ thay đổi về mặt hình thức. |
1. Thành phần
- Thành phần hoạt chất: Rivaroxaban 2,5 mg.
- Thành phần tá dược: lactose monohydrat, cellulose vi tinh thể PH 101, natri croscarmellose, natri lauryl sulfat, magnesi stearat, hypromellose, sắt oxid vàng, PEG 6000, titan dioxid.
2. Công dụng (Chỉ định)
- Phối hợp với acid acetylsalicylic (ASA) hoặc với ASA có kết hợp với clopidogrel hoặc ticlopidin chỉ định dự phòng biến cố xơ vữa động mạch ở người lớn sau hội chứng mạch vành cấp (ACS) có tăng các dấu ấn sinh học của tim.
- Phối hợp với acid acetylsalicylic chỉ định dự phòng biến cố xơ vữa động mạch ở người lớn mắc bệnh động mạch vành (CAD) hoặc bệnh động mạch ngoại biên có triệu chứng (PAD) có nguy cơ cao bị thiếu máu cục bộ.
3. Cách dùng – Liều dùng
– Cách dùng
- Sử dụng đường uống.
- Có thể dùng cùng thức ăn hoặc không.
- Đối với những bệnh nhân không thể nuốt cả viên. Có thể nghiền viên thuốc và trộn với nước hoặc nước ép táo ngay trước khi sử dụng và sử dụng đường uống.
- Viên thuốc sau nghiền cũng có thể được cho qua ống thông dạ dày với một lượng nước nhỏ và sau đó tráng ống bằng nước.
– Liều dùng
Liều dùng khuyến cáo là 2,5 mg x 2 lần/ngày.
ACS
- Bệnh nhân sử dụng rivaroxaban 2,5 mg x 2 lần/ngày nên sử dụng cùng liều hàng ngày 75 – 100 mg ASA hoặc liều hàng ngày 75 – 100 mg ASA phối hợp với liều hàng ngày 75 mg clopidogrel hoặc một liều tiêu chuẩn hàng ngày của ticlopidin. Điều trị nên được đánh giá thường xuyên ở từng bệnh nhân để cân nhắc nguy cơ biến cố thiếu máu cục bộ với nguy với chảy máu. Thời gian điều trị trên từng bệnh nhân chỉ nên kéo dài 12 tháng do kinh nghiệm điều trị kéo dài tới 24 tháng còn hạn chế.
- Điều trị với rivaroxaban nên bắt đầu càng sớm càng tốt sau khi ổn định biến cố ACS, sớm nhất 24 giờ sau khi nhập viện và ở thời điểm ngừng điều trị chống đông bằng đường tiêm.
CAD/PAD
- Bệnh nhân sử dụng rivaroxaban 2,5 mg x 2 lần/ngày nên sử dụng cùng liều hàng ngày 75 – 100 mgASA.
- Khoảng thời gian điều trị nên được xem xét trên từng bệnh nhân dựa trên các đánh giá thường xuyên và nên cân nhắc nguy cơ biến cố huyết khối so với nguy cơ chảy máu.
- Ở những bệnh nhân có biến cố huyết khối cấp tính hoặc thủ thuật can thiệp mạch và cần liệu pháp kháng tiểu cầu kép, tiếp tục sử dụng rivaroxaban 2,5 mg x 2 lần/ngày tùy thuộc vào loại biến cố hoặc thủ thuật và chế độ liều kháng tiểu cầu. Hiệu quả và an toàn của rivaroxaban 2,5 mg x 2 lần/ngày kết hợp với ASA và clopidogrel/ticlopidin chỉ được nghiên cứu ở những bệnh nhân bị ACS gần đây. Liệu pháp kháng tiểu cầu kép phối hợp với rivaroxaban 2,5 mg x 2 lần/ngày chưa được nghiên cứu ở những bệnh nhân mắc CAD/PAD.
- Nếu bỏ lỡ một liều, bệnh nhân nên tiếp tục dùng liều khuyến cáo ở lần tiếp theo. Không nên gấp đôi liều để bù cho liều đã bỏ lỡ.
Chuyển từ thuốc đối kháng Vitamin K (VKA) sang rivaroxaban
Khi bệnh nhân chuyển từ VKA sang rivaroxaban, các giá trị INR có thể tăng không đúng sau khi sử dụng rivaroxaban. INR không có giá trị đo lường hoạt tính chống động của rivaroxaban, do đó không nên sử dụng.
Chuyển từ rivaroxaban sang thuốc đối kháng Vitamin K
- Có nguy cơ không đạt hiệu quả chống đông trong quá trình chuyển từ rivaroxaban sang VKA. Cần phải đảm bảo chống đông liên tục đầy đủ trong quá trình chuyển sang thuốc chống đông thay thế. Chú ý rivaroxaban có thể góp phần làm tăng INR.
- Ở những bệnh nhân chuyển từ rivaroxaban sang VKA, VKA nên sử dụng đồng thời cho đến khi INR ≥ 2. Trong 2 ngày đầu tiên của quá trình chuyển đổi, ban đầu nên sử dụng liều VKA tiêu chuẩn, sau đó là liều VKA theo hướng dẫn của xét nghiệm INR. Trong khi bệnh nhân sử dụng cả rivaroxaban và VKA, không nên kiểm tra INR sớm hơn 24 giờ sau liều đầu tiên mà trước liều rivaroxaban tiếp theo. Sau khi ngừng rivaroxaban, xét nghiệm INR có thể đáng tin sau ít nhất 24 giờ sau liều cuối cùng.
Chuyển từ thuốc chống đông đường tĩnh mạch sang rivaroxaban
Ở những bệnh nhân hiện đang sử dụng thuốc chống động đường tĩnh mạch, ngừng thuốc chống đông đường tĩnh mạch và bắt đầu sử dụng rivaroxaban 0 – 2 giờ trước thời điểm dùng thuốc đường tĩnh mạch liều tiếp theo (ví dụ heparin trọng lượng phân tử thấp) hoặc thời điểm ngừng sử dụng thuốc đường tĩnh mạch liên tục (ví dụ heparin không phân đoạn tiêm tĩnh mạch).
Chuyển từ rivaroxaban sang thuốc chống động đường tĩnh mạch
Sử dụng liều chống đông đường tĩnh mạch đầu tiên tại thời điểm dùng liều rivaroxaban tiếp theo.
Đối tượng đặc biệt
Suy thận
- Dữ liệu lâm sàng hạn chế ở những bệnh nhân suy thận nặng (độ thanh thải creatinin 15 – 29 ml/phút) thể hiện nồng độ rivaroxaban trong huyết tương tăng đáng kể. Do đó, rivaroxaban phải được sử dụng thận trọng ở những bệnh nhân này. Không nên sử dụng ở những bệnh nhân có độ thanh thải creatinin < 15ml/phút.
- Không cần hiệu chỉnh liều ở những bệnh nhân suy thận nhẹ (độ thanh thải creatinin 50 – 80 ml/phút) hoặc suy thận vừa (độ thanh thải creatinin 30–49 ml/phút).
Suy gan
Rivaroxaban chống chỉ định ở những bệnh nhân mắc bệnh gan liên quan đến rối loạn đông máu và nguy cơ chảy máu có ý nghĩa lâm sàng bao gồm cả bệnh nhân xơ gan với Child Pugh B và C.
Người cao tuổi
- Không cần hiệu chỉnh liều.
- Nguy cơ chảy máu tăng khi tuổi tăng.
Trọng lượng cơ thể
Không cần hiệu chỉnh liều.
Giới tính
Không cần hiệu chỉnh liều.
Trẻ em
An toàn và hiệu quả của rivaroxaban ở trẻ em 0 – 18 tuổi chưa được thiết lập. Không có dữ liệu sẵn có. Do đó, không khuyến cáo sử dụng ở trẻ em dưới 18 tuổi.
– Quá liều
- Hiếm các trường hợp quá liều lên tới 600 mg được báo cáo không có biến chứng chảy máu hoặc các phản ứng bất lợi khác. Do hấp thu hạn chế, tác dụng ở mức tối đa mà không có sự gia tăng phơi nhiễm trong huyết tương trung bình có thể xảy ra mức liều trên liều điều trị: trên 50 mg.
- Không có thuốc giải độc đặc hiệu đối kháng tác dụng dược lực của rivaroxaban. Việc sử dụng than hoạt tính làm giảm hấp thu trong trường hợp quá liều rivaroxaban có thể được xem xét.
Xử trí chảy máu
- Nếu một biến chứng chảy máu xảy ra ở bệnh nhân đang dùng rivaroxaban, cần trì hoãn dùng liều tiếp theo hoặc ngừng điều trị nếu phù hợp. Rivaroxaban có thời gian bán hủy khoảng 5 đến 13 giờ. Xử trí cho từng cá nhân tùy theo mức độ nghiêm trọng và vị trí xuất huyết. Điều trị triệu chứng thích hợp có thể được sử dụng khi cần thiết, chẳng hạn như nén ép cơ học (ví dụ như đối với chảy máu cam nặng), cầm máu phẫu thuật với các thủ thuật kiểm soát chảy máu, truyền dịch và hỗ trợ về huyết động học, các sản phẩm máu (hồng cầu lắng hoặc huyết tương đông lạnh tươi, tùy thuộc vào tình trạng thiếu máu hoặc bệnh đông máu đi kèm) hoặc tiểu cầu.
- Nếu chảy máu không thể kiểm soát được bằng các biện pháp trên, xem xét dùng một chất thay đổi tiền đông máu đặc hiệu, chẳng hạn như phức hợp prothrombin cô đặc (PCC), phức hợp prothrombin cô đặc được hoạt hóa (APCC), hoặc yếu tố tái tổ hợp Vlla (r-FVlla). Tuy nhiên, hiện nay kinh nghiệm lâm sàng còn rất hạn chế với việc sử dụng các sản phẩm này trên những người đang dùng rivaroxaban. Khuyến cáo cũng dựa trên các dữ liệu phi lâm sàng. Sử dụng lại liều của yếu tố tái tổ hợp Villa nên được xem xét chuẩn độ phụ thuộc vào sự cải thiện chảy máu. Tùy vào tính có sẵn ở địa phương, xem xét xin tư vấn của chuyên gia đông máu trong trường hợp chảy máu nặng.
- Protamin sulfat và vitamin K sẽ không được xem là có ảnh hưởng đến hoạt tính chống đông máu của rivaroxaban. Kinh nghiệm còn hạn chế với acid tranexamic và không có kinh nghiệm với acid aminocaproic và aprotinin ở người dùng rivaroxaban. Không có lý do khoa học cho lợi ích cũng như kinh nghiệm với việc sử dụng desmopressin cầm máu toàn thân trên những người dùng rivaroxaban. Do rivaroxaban liên kết với protein huyết tương cao nên không thể loại thuốc bằng thẩm tách máu.
4. Chống chỉ định
- Mẫn cảm với rivaroxaban hoặc với bất kì thành phần nào của thuốc.
- Chảy máu có ý nghĩa trên lâm sàng.
- Tổn thương hoặc bệnh lý được xem là nguy cơ gây chảy máu nghiêm trọng. Có thể bao gồm loét đường tiêu hóa hiện tại hoặc gần đây; xuất hiện khối u ác tính có nguy cơ chảy máu cao; chấn thương não hoặc cột sống gần đầy; phẫu thuật não, cột sống hoặc nhãn khoa gần đây; xuất huyết nội sọ gần đây; giãn tĩnh mạch thực quản đã biết hoặc nghi ngờ, dị dạng động mạch, phình động mạch hoặc bất thường mạch máu nội sọ hoặc trong cột sống.
- Sử dụng đồng thời với các thuốc chống đông khác, ví dụ heparin không phân đoạn (UFH), heparin trọng lượng phân tử thấp (enoxaparin, dalteparin, v.v…), dẫn xuất của heparin (fondaparinux, v.v…), chống đông đường uống (warfarin, dabigatran etexilat, apixaban, v.v…) ngoại trừ các trường hợp cụ thể của việc chuyển đổi liệu pháp chống đông máu hoặc khi dùng UFH với liều cần thiết để duy trì ống thông tĩnh mạch hoặc động mạch trung tâm mở.
- Điều trị đồng thời ACS với liệu pháp kháng tiểu cầu ở những bệnh nhân có tiền sử đột quỵ hoặc cơn thiếu máu não thoáng qua (TIA).
- Điều trị đồng thời CAD/PAD với ASA ở những bệnh nhân có tiền sử đột quỵ lỗ khuyết hoặc xuất huyết hoặc bất kỳ đột quỵ nào trong vòng 1 tháng.
- Bệnh gan liên quan đến rối loạn đông máu và nguy cơ chảy máu có ý nghĩa lâm sàng bao gồm cả bệnh nhân xơ gan Child Pugh B và C.
- Phụ nữ có thai và cho con bú.
5. Tác dụng phụ
Tóm tắt thông tin an toàn
An toàn của rivaroxaban được đánh giá ở 13 nghiên cứu pha III gồm 53103 bệnh nhân sử dụng rivaroxaban.
Bảng 1: Số bệnh nhân nghiên cứu, tổng liều hàng ngày và khoảng thời gian điều trị tối đa trong các nghiên cứu pha III
| Chỉ định | Số bệnh nhân* | Tổng liều hàng ngày | Khoảng thời gian điều trị tối đa |
| Phòng ngừa huyết khối tĩnh mạch (VTE) ở người lớn trải qua phẫu thuật thay khớp háng hoặc khớp gối | 6097 | 10 mg | 39 ngày |
| Phòng ngừa VTE ở những bệnh nhân mắc bệnh nội khoa | 3997 | 10 mg | 39 ngày |
| Điều trị huyết khối tĩnh mạch sâu (DVT), tắc mạch phổi (PE) và phòng ngừa tái phát | 6790 | Ngày 1 – 21: 30 mg Ngày 22 trở đi: 20 mg Sau ít nhất 6 tháng: 10 mg hoặc 20 mg | 21 tháng |
| Phòng ngừa đột quỵ và thuyên tắc hệ thống ở những bệnh nhân rung nhĩ không do van tim | 7750 | 20 mg | 41 tháng |
| Phòng ngừa biến cố xơ vữa động mạch ở những bệnh nhân sau một hội chứng mạch vành cấp (ACS) | 10225 | Tương ứng 5 hoặc 10 mg, sử dụng cùng với ASA hoặc ASA cộng clopidogrel/ticlodipin | 31 tháng |
| Phòng ngừa biến cố xơ vữa động mạch ở những bệnh nhân CAD/PAD | 18244 | 5 mg sử dụng đồng thời với ASA hoặc 10 mg sử dụng đơn trị liệu | 47 tháng |
| *Bệnh nhân phơi nhiễm với ít nhất 1 liều rivaroxaban | |||
Phản ứng bất lợi được báo cáo thường gặp nhất là chảy máu. Chảy máu được báo cáo thường gặp nhất là chảy máu cam và xuất huyết đường tiêu hóa (3,8%).
Bảng 2: Biến cố chảy máu* và thiếu máu ở những bệnh nhân phơi nhiễm với rivaroxaban trong các nghiên cứu pha III đã hoàn thành
| Chỉ định | Bất kỳ chảy máu nào | Thiếu máu |
| Phòng ngừa huyết khối tĩnh mạch (VTE) ở người lớn trải qua phẫu thuật thay khớp háng hoặc khớp gối | 6,8% bệnh nhân | 5,9% bệnh nhân |
| Phòng ngừa VTE ở những bệnh nhân mắc bệnh nội khoa | 12,6% bệnh nhân | 2,1% bệnh nhân |
| Điều trị huyết khối tĩnh mạch sâu (DVT), tắc mạch phổi (PE) và phòng ngừa tái phát | 23% bệnh nhân | 1,6% bệnh nhân |
| Phòng ngừa đột quỵ và thuyên tắc hệ thống ở những bệnh nhân rung nhĩ không do van tim | 28/100 bệnh nhân năm | 2,5/100 bệnh nhân năm |
| Phòng ngừa biến cố xơ vữa động mạch ở những bệnh nhân sau một hội chứng mạch vành cấp (ACS) | 22/100 bệnh nhân năm | 1,4/100 bệnh nhân năm |
| Phòng ngừa biến cố xơ vữa động mạch ở những bệnh nhân CAD/PAD | 6,7/100 bệnh nhân năm | 0,15/100 bệnh nhân năm** |
| *Đối với tất cả các nghiên cứu về rivaroxaban, tất cả các biến cố chảy máu được thu thập, báo cáo và hiệu chỉnh **Trong nghiên cứu COMPASS, tỷ lệ thiếu máu thấp do cách tiếp cận chọn lọc được áp dụng với việc thu thập các biến cố bất lợi | ||
Danh sách liệt kê các biến cố bất lợi
Phân loại phản ứng bất lợi theo tần suất như sau: rất thường gặp (≥ 1/10), thường gặp (≥ 1/100 đến < 1/10), ít gặp (≥ 1/1000 đến < 1/100), hiếm gặp (≥ 1/10000 đến < 1/1000), rất hiếm (< 1/10000), không rõ tần suất (không ước lượng được từ dữ liệu lâm sàng).
Bảng 3: Tất cả các phản ứng bất lợi được báo cáo ở các bệnh nhân trong thử nghiệm lâm sàng pha III hoặc trong giai đoạn hậu mại
| Thường gặp | Ít gặp | Hiếm | Rất hiếm | Không rõ tần suất |
| Rối loạn máu và hệ bạch huyết | ||||
| Thiếu máu (bao gồm các chỉ số xét nghiệm tương ứng) | Tăng tiểu cầuA, giảm tiểu cầu | |||
| Rối loạn hệ miễn dịch | ||||
| Phản ứng dị ứng, viêm da dị ứng, phù mạch và phù dị ứng | Các phản ứng phản vệ bao gồm sốc phản vệ | |||
| Rối loạn hệ thần kinh | ||||
| Đau đầu, chóng mặt | Xuất huyết não và nội sọ, ngất | |||
| Rối loạn mắt | ||||
| Xuất huyết mắt (bao gồm xuất huyết kết mạc) | ||||
| Rối loạn tim | ||||
| Nhịp tim nhanh | ||||
| Rối loạn mạch | ||||
| Hạ huyết áp, khối tụ máu | ||||
| Rối loạn hô hấp, lồng ngực và trung thất | ||||
| Chảy máu cam, ho ra máu | ||||
| Rối loạn tiêu hóa | ||||
| Chảy máu lợi, xuất huyết tiêu hóa (bao gồm xuất huyết trực tràng), đau bụng, khó tiêu, buồn nôn, táo bónA, tiêu chảy, nônA | Khô miệng | |||
| Rối loạn gan – mật | ||||
| Tăng transaminase | Suy gan, tăng billirubin, tăng phosphatase kiềmA, tăng GGTA | Vàng da, tăng billirubin liên hợp (có hoặc không tăng đồng thời ALT), ứ mật, viêm gan (bao gồm tổn thương tế bào gan) | ||
| Rối loạn da và mô dưới da | ||||
| Ngứa, phát ban, chàm, xuất huyết da và dưới da | Mề đay | Hội chứng Stevens-Johnson/hoại tử biểu bì độc hại, hội chứng DRESS | ||
| Rối loạn cơ xương và mô liên kết | ||||
| Đau tứ chiA | Tràn máu khớp | Xuất huyết cơ | Hội chứng chèn ép khoang thứ phát do chảy máu | |
| Rối loạn thận và tiết niệu | ||||
| Xuất huyết đường sinh dục (bao gồm tiểu máu và rong kinhB), suy thận (bao gồm tăng creatinin máu, tăng ure máuA) | Suy thận/suy thận cấp thứ phát do chảy máu đủ để gây giảm tưới máu | |||
| Rối loạn chung và vị trí sử dụng | ||||
| SốtA, phù ngoại vi, giảm năng lượng và thể chất chung (suy nhược, mệt mỏi) | Cảm thấy không khỏe | Phù cục bộA | ||
| Khảo sát | ||||
| Tăng LDHA, tăng lipaseA, tăng amylaseA | ||||
| Chấn thương, ngộ độc, các biến chứng về thủ thuật | ||||
| Xuất huyết hậu sản (bao gồm thiếu máu hậu phẫu và xuất huyết vết thương), truyền nhiễm | Giả phình động mạch vànhC | |||
| A: quan sát được trong phòng ngừa huyết khối tĩnh mạch (VTE) ở người lớn trải qua phẫu thuật thay khớp háng hoặc khớp gối. B: quan sát được trong điều trị DVT, PE và phòng ngừa tái phát, rất thường gặp ở phụ nữ < 55 tuổi. C: quan sát được ở tần suất ít gặp trong phòng ngừa biến cố xơ vữa động mạch ở những bệnh nhân sau một hội chứng mạch vành cấp (ACS). | ||||
6. Lưu ý |
– Thận trọng khi sử dụng
Nguy cơ xuất huyết
Suy thận
Tương tác với các thuốc khác
Các yếu tố nguy cơ xuất huyết khác Như với các thuốc chống huyết khối khác, rivaroxaban không nên dùng ở những bệnh nhân có nguy cơ chảy máu cao như:
Bệnh nhân có van giả An toàn và hiệu quả của rivaroxaban chưa được nghiên cứu ở các bệnh nhân có van tim giả, do đó không có dữ liệu cho thấy rivaroxaban cung cấp đầy đủ tác dụng chống đông ở nhóm bệnh nhân này. Không khuyến cáo điều trị bằng rivaroxaban cho những bệnh nhân này. Bệnh nhân mắc hội chứng antiphospholipid Các thuốc chống đông đường uống tác dụng trực tiếp (DOACs) bao gồm rivaroxaban không khuyến cáo sử dụng ở những bệnh nhân có tiền sử huyết khối mà được chẩn đoán mắc hội chứng antiphospholipid. Đặc biệt ở những bệnh nhân dương tính gấp 3 (đối với kháng đông lupus, kháng thể anticardiolipin và kháng thể anti-beta 2-glycoprotein l), điều trị bằng DOACs có thể làm tăng tỉ lệ mắc biến cố huyết khối tái phát so với điều trị bằng thuốc đối kháng vitamin K. Bệnh nhân có tiền sử đột quỵ và hoặc TIA Bệnh nhân mắc ACS Rivaroxaban 2,5 mg chống chỉ định điều trị ACS ở những bệnh nhân có tiền sử đột quỵ hoặc TIA. Một số bệnh nhân ACS có tiền sử đột quỵ hoặc TIA được nghiên cứu nhưng dữ liệu hiệu quả hạn chế sẵn có thể hiện bệnh nhân không có lợi từ việc điều trị. Bệnh nhân mắc CAD/PAD Bệnh nhân có tiền sử đột quỵ lỗ khuyết hoặc xuất huyết hoặc đột quỵ do thiếu máu cục bộ hoặc không do thiếu máu cục bộ trong một vài tháng chưa được nghiên cứu. Gây tê hoặc chọc dò tủy sống/ngoài màng cứng
Người già Tuổi tăng có thể tăng nguy cơ xuất huyết. Các phản ứng da Phản ứng da nghiêm trọng, bao gồm hội chứng Stevens-Johnson/hoại tử biểu bì độc hại và hội chứng DRESS đã được báo cáo trong quá trình giám sát trong giai đoạn hậu mại liên quan đến việc sử dụng rivaroxaban. Bệnh nhân thường xuất hiện sớm các nguy cơ này trong quá trình điều trị: khởi phát của phản ứng xảy ra trong phần lớn các trường hợp trong những tuần đầu điều trị. Nên ngừng sử dụng rivaroxaban nếu xuất hiện lần đầu phát ban da nghiêm trọng (như ran lộng, dữ dội và/hoặc phồng rộp) hoặc bất kỳ dấu hiệu mẫn cảm nào khác kết hợp với tổn thương niêm mạc. Thông tin về tá dược Thuốc có chứa lactose monohydrat, do đó nên hỏi ý kiến bác sĩ trước khi dùng nếu có tình trạng không dung nạp đường. Không nên dùng thuốc này ở bệnh nhân có các di truyền hiếm gặp về không dung nạp lactose do thiếu hụt enzyme lactase hoặc kém hấp thu glucose-galactose. – Thai kỳ và cho con búPhụ nữ có thai
Phụ nữ cho con bú An toàn và hiệu quả của rivaroxaban chưa được thiết lập ở phụ nữ cho con bú. Dữ liệu trên động vật thể hiện rivaroxaban được bài tiết qua sữa mẹ. Do đó chống chỉ định sử dụng rivaroxaban trong quá trình cho con bú. Phải đưa ra quyết định liệu nên ngừng cho con bú hay ngừng/kiêng điều trị. – Khả năng lái xe và vận hành máy mócRivaroxaban có ảnh hưởng nhẹ lên khả năng lái xe và vận hành máy móc. Các phản ứng bất lợi như ngất (tần suất: không thường gặp) và chóng mặt (tần suất: thường gặp) đã được báo cáo. Bệnh nhân gặp những phản ứng này không nên lái xe và vận hành máy móc. – Tương tác thuốcCác thuốc ức chế CYP3A4 và P-gp
Các thuốc chống đông máu
NSAIDs/các thuốc ức chế kết tập tiểu cầu
SSRIs/SNRIs Cũng như các thuốc chống đông máu khác, bệnh nhân có thể tăng nguy cơ chảy máu nếu dùng cùng với SSRIs hoặc SNRIs. Warfarin
Các thuốc cảm ứng CYP3A4 Sử dụng đồng thời rivaroxaban với rifampicin – chất cảm ứng CYP3A4 mạnh làm giảm khoảng 50% AUC trung bình của rivaroxaban, song song với giảm tác dụng dược lực của rivaroxaban. Sử dụng đồng thời rivaroxaban với các chất cảm ứng mạnh CYP3A4 khác (ví dụ phenytoin, carbamazepin, phenobarbital hoặc St. John’s Wort) có thể làm giảm nồng độ trong huyết tương của rivaroxaban. Do đó, nên tránh dùng đồng thời các thuốc cảm ứng CYP3A4 mạnh trừ khi bệnh nhận được theo dõi chặt chẽ các dấu hiệu và triệu chứng của huyết khối. Các điều trị đồng thời khác
Các xét nghiệm Các chỉ số đông máu (ví dụ: PT, aPTT, Heptest) ảnh hưởng như dự đoán bởi cơ chế hoạt động của rivaroxaban. |
7. Dược lý
– Dược lực học (Tác động của thuốc lên cơ thể)
Nhóm dược lý: Thuốc chống huyết khối, thuốc ức chế yếu tố Xa trực tiếp.
Mã ATC: B01AF01.
Cơ chế tác dụng:
Rivaroxaban là một chất ức chế chọn lọc cao và trực tiếp yếu tố Xa với sinh khả dụng đường uống. Ức chế yếu tố Xa làm gián đoạn con đường nội sinh và ngoại sinh của dòng máu đông, ức chế cả sự hình thành thrombin và phát triển của thrombin. Rivaroxaban được chứng minh không ức chế thrombin (yếu tố hoạt hóa II) và không ảnh hưởng lên tiểu cầu.
Tác dụng dược lực học
- Sự ức chế hoạt tính của yếu tố Xa phụ thuộc liều đã được quan sát thấy trên người. Thời gian prothrombin (PT) bị ảnh hưởng lệ thuộc theo liều rivaroxaban sử dụng, có tương quan chặt chẽ với nồng độ huyết tương (giá trị r bằng 0,98) nếu dùng Neoplastin để thử. Các thuốc thử khác có thể cho các kết quả khác nhau. Kết quả cho PT được tính theo giây, chỉ số INR (Tỷ lệ chuẩn hóa quốc tế) chỉ được hiệu chuẩn và có thẩm định đối với coumarin và không thể sử dụng cho bất cứ thuốc chống đông khác.
- Thời gian hoạt hóa một phần thromboplastin (aPTT) và HepTest cũng bị kéo dài phụ thuộc vào liều dùng; tuy nhiên không khuyến cáo sử dụng các chỉ số này để đánh giá tác dụng dược lực của rivaroxaban. Không cần thiết phải theo dõi các tham số đông máu trong quá trình điều trị với rivaroxaban. Tuy nhiên, nếu được chỉ định lâm sàng, nồng độ rivaroxaban có thể được đo bằng xét nghiệm kháng yếu tố Xa đã hiệu chuẩn.
– Dược động học (Tác động của cơ thể với thuốc)
Hấp thu
- Rivaroxaban hấp thu nhanh với nồng độ tối đa (Cmax) đạt được trong 2 – 4 giờ sau khi dùng viên nén.
- Hấp thu qua đường uống của rivaroxaban gần như hoàn toàn và sinh khả dụng cao (80 – 100%) đối với liều 2,5 mg và 10 mg. Ở mức liều 2,5 mg và 10 mg, sử dụng cùng thức ăn không ảnh hưởng đến AUC hoặc Cmax của rivaroxaban. Viên nén 2,5 mg và 10 mg có thể sử dùng cùng hoặc không cùng thức ăn.
- Dược động học của rivaroxaban gần như tuyến tính tới khoảng 15 mg x 1 lần/ngày. Ở mức liều cao hơn, sinh khả dụng và tốc độ hấp thu của rivaroxaban giảm.
- Hấp thu của rivaroxaban phụ thuộc vào vị trí và phân bố trong đường tiêu hóa. AUC và Cmax giảm 29% và 56% so sánh với viên nén có các hạt rivaroxaban phân bố ở đoạn đầu ruột non. Phơi nhiễm giảm hơn nữa khi rivaroxaban phân bố ở đoạn xa ruột non hoặc đoạn đầu đại tràng.
- So với uống toàn viên thuốc, sinh khả dụng (AUC và Cmax) tương tự với viên nén rivaroxaban 20 mg dùng đường uống khi được nghiền ra và trộn vào nước ép táo hoặc phân tán trong nước và dùng qua ống thông dạ dày, tiếp theo sau đó là bữa ăn lỏng. Do đặc tính dược động học tỷ lệ với liều và có thể dự đoán được của rivaroxaban, nên sinh khả dụng từ nghiên cứu này có thể áp dụng cho liễu rivaroxaban thấp hơn.
Phân bố
Thuốc liên kết cao với protein huyết tương người, khoảng 92 – 95%, chủ yếu liên kết với albumin. Thể tích phân bố ở mức vừa phải với Vss khoảng 50 lít.
Chuyển hóa và thải trừ
- Khoảng 2/3 liều rivaroxaban uống vào bị thoái biến do chuyển hóa, sau đó một nửa sẽ được thải trừ qua thận và phần còn lại qua phân. 1/3 liều dùng được thải trừ trực tiếp qua thận dưới dạng không chuyển hóa trong nước tiểu, chủ yếu qua bài tiết tích cực ở thận.
- Rivaroxaban được chuyển hóa nhờ CYP3A4, CYP2J2, và cơ chế độc lập với CYP. Sự thoái biến do oxy hóa phân đối morpholinon và thủy phân các liên kết amid là các vị trí sinh chuyển hóa chính. Dựa trên các nghiên cứu in vitro, rivaroxaban là cơ chất của protein vận chuyển P-gp (P-glycoprotein) và Bcrp (protein đối kháng ung thư vú).
- Rivaroxaban dạng không bị chuyển hóa là hợp chất quan trọng nhất trong huyết tương người, không có chất chuyển hóa tuần hoàn chủ yếu hoặc có hoạt tính nào. Với độ thanh thải toàn phần khoảng 10 L/giờ, có thể xếp rivaroxaban vào nhóm các thuốc thanh thải chậm.
- Sau khi tiêm tĩnh mạch liều 1 mg thời gian bán hủy khoảng 4,5 giờ.
- Sự thải trừ của rivaroxaban khỏi huyết tương xảy ra với thời gian bán hủy từ 5 đến 9 giờ ở người trẻ tuổi và từ 11 đến 13 giờ ở người cao tuổi.
Đối tượng cụ thể
Giới tính
Không có khác biệt có ý nghĩa lâm sàng về dược động học và dược lực học giữa các bệnh nhân nam và nữ.
Người cao tuổi
Người cao tuổi có nồng độ thuốc trong huyết tương cao hơn người trẻ, với giá trị AUC gấp khoảng 1,5 lần và chủ yếu do giảm độ thanh thải thận và toàn phần. Không cần hiệu chỉnh liều.
Cân nặng
Quá khác nhau về trọng lượng cơ thể (< 50 kg hoặc > 120 kg) chỉ có ảnh hưởng nhỏ lên nồng độ trong huyết tương của rivaroxaban (dưới 25%). Không cần hiệu chỉnh liều.
Chủng tộc khác nhau
Không có khác biệt có ý nghĩa lâm sàng về dược động học và dược lực học của rivaroxaban giữa các bệnh nhân người da trắng, người Mỹ gốc Phi, người Tây Ban Nha, người Nhật Bản hoặc người Trung Quốc.
Suy gan
- Bệnh nhân xơ gan có suy gan gan nhẹ (phân loại Child Pugh A) chỉ bị thay đổi nhỏ về dược động học của rivaroxaban (AUC trung bình của rivaroxaban tăng gấp 1,2 lần), gần như có thể so sánh với nhóm chứng khỏe mạnh. Ở bệnh nhân xơ gan có suy gan trung bình (phân loại Child Pugh B), AUC trung bình của rivaroxaban tăng lên đáng kể, gấp 2,3 lần so với người tình nguyện khoẻ mạnh. AUC của phần thuốc tự do tăng lên 2,6 lần. Bệnh nhân giảm độ thanh thải thận của rivaroxaban, tương tự với bệnh nhân suy thận vừa. Không có dữ liệu trên bệnh nhân suy gan nặng.
- Sự ức chế hoạt tính của yếu tố Xa tăng lên với hệ số 2,6 ở những bệnh nhân suy gan vừa khi so sánh với người tình nguyện khỏe mạnh, sự kéo dài thời gian PT cũng tăng lên tương tự với hệ số 2,1. Bệnh nhân suy gan trung bình nhạy cảm hơn với rivaroxaban, dẫn tới mối tương quan PK/PD giữa nồng độ thuốc và PT tăng dốc đứng hơn.
- Rivaroxaban chống chỉ định ở những bệnh nhân mắc bệnh gan liên quan đến rối loạn đông máu và nguy cơ chảy máu có ý nghĩa lâm sàng, bao gồm cả bệnh nhân xơ gan với Child Pugh B và C.
Suy thận
- Sự phơi nhiễm rivaroxaban tăng lên tương quan với sự giảm chức năng thận, được đánh giá thông qua độ thanh thải creatinin.
- Ở bệnh nhân suy thận nhẹ (độ thanh thải creatinin 50 – 80 mL/phút), vừa (độ thanh thải creatinin 30 – 49 mL/phút) hoặc nặng (độ thanh thải creatinin 15 – 29 mL/phút), nồng độ rivaroxaban huyết tương (AUC) tương ứng tăng lên gấp 1,4; 1,5 và 1,6 lần so với trên người tình nguyện khỏe mạnh. Sự tăng tương ứng của tác dụng dược lực học rõ ràng hơn. Ở bệnh nhân suy thận nhẹ, vừa hoặc nặng, hoạt tính ức chế yếu tố Xa tổng thể tăng lên với hệ số tương ứng là 1,5; 1,9 và 2,0 khi so sánh với người tình nguyện khoẻ mạnh; kéo dài thời gian PT cũng tăng tương tự với hệ số tương ứng là 1,3; 2,2 và 2,4. Không có dữ liệu trên bệnh nhân với có độ thanh thải creatinin < 15 mL/phút.
- Do liên kết protein huyết tương cao nên thẩm tách máu không loại được rivaroxaban.
- Không khuyến cáo sử dụng thuốc cho bệnh nhân có độ thanh thải creatinine < 15 ml/phút. Sử dụng thận trọng rivaroxaban trên bệnh nhân suy thận nặng có độ thanh thải creatinin 15 – 29 ml/phút.
Trẻ em
An toàn và hiệu quả chưa được thiết lập ở trẻ em và thanh thiếu niên dưới 18 tuổi.
Mối tương quan PK/PD
Mối tương quan PK/PD giữa nồng độ trong huyết tương của rivaroxaban và một vài điểm cuối PD (ức chế yếu tố Xa, PT, aPTT, Heptest) được đánh giá sau khi sử dụng một khoảng liều rộng (5 – 30 mg x 2 lần/ngày). Mối tương quan giữa rivaroxaban và hoạt tính của yếu tố Xa được mô tả tốt nhất bằng mô hình Emax. Đối với PT, mô hình chắn tuyến tính mô tả dữ liệu tốt hơn. Tùy thuộc vào các thuốc thử PT khác nhau, độ dốc cũng khác nhau đáng kể. Khi Neoplastin PT được sử dụng, PT nền là 13 giây và độ dốc khoảng 3 – 4s/100mcgl. Kết quả phân tích PK/PD trong pha II và III phù hợp với các dữ liệu được thiết lập ở các đối tượng khỏe mạnh.
8. Thông tin thêm
– Đặc điểm
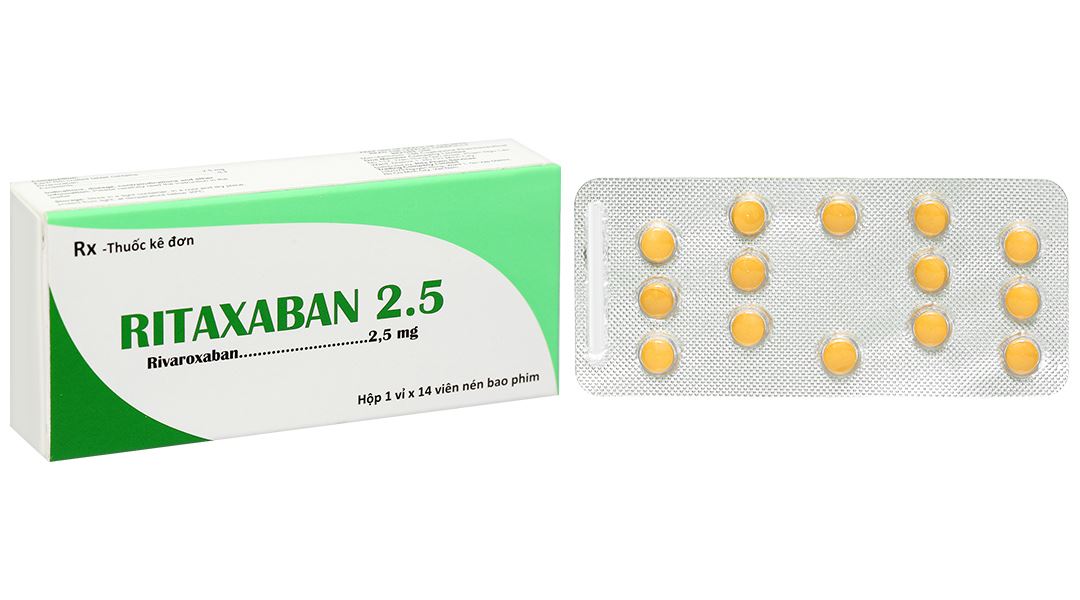
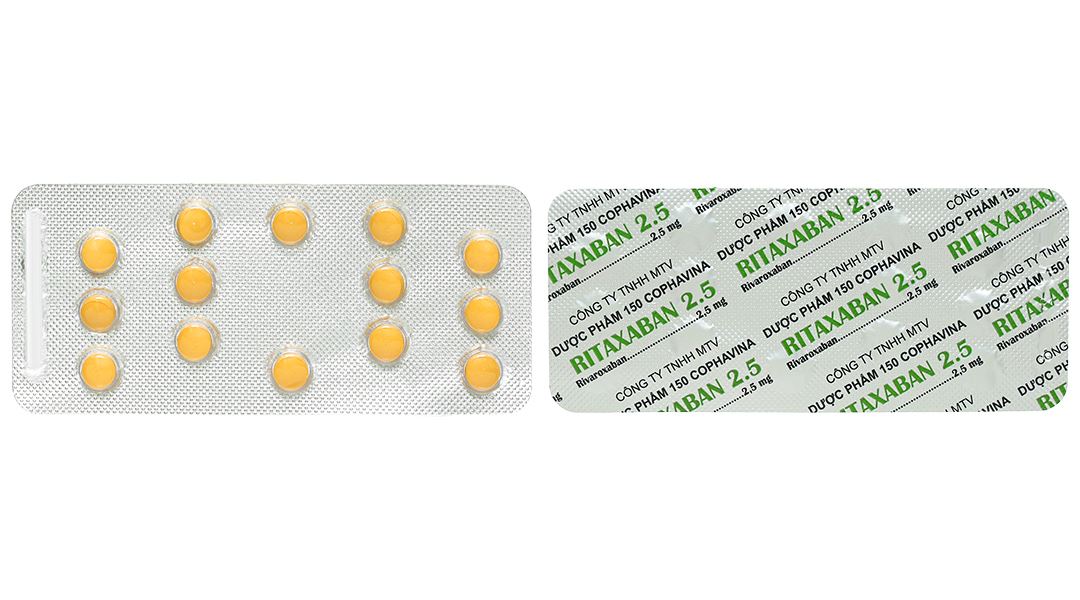
Viên nén bao phim hình tròn, màu vàng.
– Bảo quản
Trong bao bì kín, nơi khô ráo, tránh ánh sáng, ở nhiệt độ dưới 30 độ C.
– Quy cách đóng gói
Hộp 1 vỉ x 14 viên.
– Hạn dùng
36 tháng kể từ ngày sản xuất.
– Nhà sản xuất
Công ty TNHH MTV Dược phẩm 150 Cophavina.









Đánh giá
Chưa có đánh giá nào.